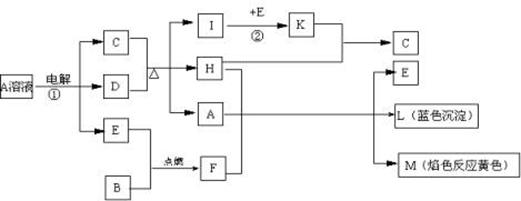
题目内容
有铁的氧化物样品,用140ml0.5mol/L的盐酸恰好使其完全溶解,所得溶液还能吸收标准状况下氯气56ml,使其中的Fe2+全部转化为Fe3+,该样品可能的化学式是( )
| A.Fe2O3 | B.Fe3O4 | C.Fe5O7 | D.Fe4O5 |
C
解析试题分析:n(HCl)="0.14L×0.5mol/L=0.07" mol,n(Cl2)="0.0025" mol,由于发生反应:2Fe2++Cl2=2Fe3++2Cl—,(
n(Fe2+),=0.5n(Cl2)="0.005" mol,最后溶液为FeCl3溶液,根据原子守恒可知;3n(Fe2++Fe3+)= n(Fe3+)最后=n(Cl-总)= n(HCl)+2n(Cl2)=" 0.07" mol+0.005 mol ="0.075" mol,所以n(Fe2++Fe3+)="0.025" mol,n(Fe3+)="0.02" mol,n(Fe2+):、n(Fe3+)的比为1:4。然后将选项中的各个复杂的氧化物变形为aFeO .bFe2O3形式。A无Fe2+离子,错误。B化学式变形为FeO .Fe2O3的化合物,二者的物质的量的比为1:2,错误。C.化学式变形为FeO. 2Fe2O3的化合物,二者的物质的量的比为1:4,正确。D 为2 FeO .Fe2O3的化合物,二者的物质的量的比为1:1,错误。
考点:考查氧化还原反应电子守恒、原子守恒等知识。

 名校课堂系列答案
名校课堂系列答案把生锈的铁钉放入足量稀盐酸中,可能发生的反应是( )
| A.只有置换反应 | B.只有复分解反应 |
| C.置换和复分解反应 | D.置换和分解反应 |
下列物质既能与NaOH溶液反应,又能与盐酸反应的是
A.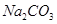 | B.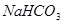 | C.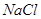 | D. |
用含少量镁粉的铝粉制取纯净的氢氧化铝,下述操作步骤中最恰当的组合是
①加盐酸溶解 ②加烧碱溶液溶解 ③过滤 ④通入过量CO2生成Al(OH)3沉淀
⑤加入盐酸生成Al(OH)3沉淀 ⑥加入过量烧碱溶液
| A.①⑥⑤③ | B.②③④③ | C.②③⑤③ | D.①③⑤③ |
利用下图装置做铝热反应实验。下列说法不正确的是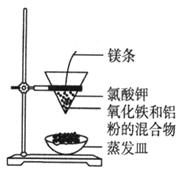
A.该反应的化学方程式是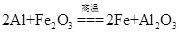 |
| B.该反应会产生高温、发出强光 |
| C.根据铝热反应的原理,可以冶炼某些金属 |
| D.若反应中转移3 mol电子,则消耗氧化剂的物质的量是1 mol |
王老师在用酒精喷灯做“铁与水蒸气反应”后,该校高一化学研究性小组同学对得到的黑色固体物质进行了如下实验:
(1)甲同学认为:该黑色固体为四氧化三铁。请写出黑色固体溶于稀盐酸的化学方程式____________;
(2)乙同学提出:根据上述实验现象甲同学的观点不可靠,理由是__________;
(3)深红色溶液C放置一段时间后,发现红色褪去。关于溶液褪色的原因,同学们纷纷猜想:
假设一:氯水有强氧化性,将溶液中的SCN—氧化;
假设二:空气中有还原性物质,将 ;
假设三:氯水有极强的氧化性,将 ;
基于假设一,为验证合理与否,可选用试剂:浓硫酸、1.0mol·L-1HNO3、1.0mol·L-1盐酸、1.0mol·L-1NaOH、0.lmol·L-1FeC13、0.lmol·L-1 CuSO4、20%KSCN、蒸馏水。
| 实验操作 | 预期现象 | 结论 |
| 取少量褪色后的溶液, | | 说明假设一是合理的 |
(4)乙同学用酒精灯加热做铁与水蒸气反应的实验,也得到了黑色固体,它不能被磁铁吸引,当加入盐酸溶解该固体时,溶液呈浅绿色,再滴加KSCN溶液不变色。由此她认为生成该固体的化学方程式为 。
常温常压下,将amolCO2气体通入1Lbmol/L的NaOH溶液中,下列对所得溶液的描述不正确的
| A.当a=2b时,随着CO2气体的通入,溶液中由水电离出的c(H+)有如右图变化关系 |
| B.当a=b时,所得溶液中存在:c(OH-)+c(CO32-)=c(H+)+c(H2CO3) |
| C.当2a=b时,所得溶液中存在:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+) |
| D.当1/2<a/b<1时,所得溶液中一定存在:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
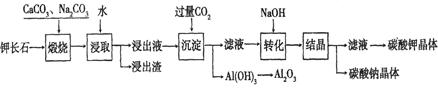
 Al(OH)3+ OH-。“浸取”时应保持溶液呈________性(填“酸”或“碱”),“浸取”时不断搅拌的目的是_____ ____。
Al(OH)3+ OH-。“浸取”时应保持溶液呈________性(填“酸”或“碱”),“浸取”时不断搅拌的目的是_____ ____。