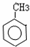
题目内容
反应2H2S(g)?2H2(g)+S2(g)△H>0,其他条件不变,下列说法正确的是( )
| A、加入催化剂,反应路径将发生改变,△H也将随之改变 |
| B、升高温度,正逆反应速率都增大,H2S分解率也增大 |
| C、增大压强,平衡向逆反应方向移动,体系温度降低 |
| D、恒容体系,充入H2重新达到平衡后,H2浓度将减小 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:反应2H2S(g)═2H2(g)+S2(g)△H>0,是正反应气体体积增大的吸热反应,据勒夏特列原理分析.
解答:
解:A、催化剂不影响焓变的大小,故A错误;
B、升温正逆反应速率都增大,平衡正向移动,反应物分解率增大,故B正确;
C、加压平衡逆向移动,逆向放热,温度升高,故C错误;
D、恒容充入氢气,平衡逆向移动,由于S2(g)的减小,影响移动程度小,氢气浓度比原平衡大,故D错误;
故选B.
B、升温正逆反应速率都增大,平衡正向移动,反应物分解率增大,故B正确;
C、加压平衡逆向移动,逆向放热,温度升高,故C错误;
D、恒容充入氢气,平衡逆向移动,由于S2(g)的减小,影响移动程度小,氢气浓度比原平衡大,故D错误;
故选B.
点评:本题考查了影响化学反应速率和影响平衡移动的因素,注意勒夏特列原理的应用,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列说法错误的是( )
| A、原子、分子、离子都可以构成物质 |
| B、由同一种元素组成的物质一定是单质 |
| C、中和反应一定是复分解反应 |
| D、置换反应中一定有单质生成 |
下列除杂方法不正确的是(括号内为杂质)( )?
| A、H2(H2S)通过CuSO4溶液洗涤? |
| B、SO2(SO3)通过饱和NaHSO3溶液洗涤? |
| C、Na2SO3溶液(Na2SO4)滴加适量的BaCl2溶液? |
| D、Na2SO4溶液(Na2SO3)滴加适量的H2SO4溶液? |
已知有以下的物质相互转化关系,A是常见的金属单质,能被磁铁吸引.
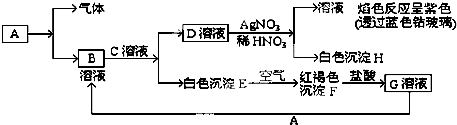
(1)试回答:写出B的化学式 C的化学式 H的化学式
(2)写出由E转变成F的化学方程式 .
(3)向G溶液加入A的有关离子反应方程式 .

(1)试回答:写出B的化学式
(2)写出由E转变成F的化学方程式
(3)向G溶液加入A的有关离子反应方程式
下列实验现象预测正确的是( )


| A、Ⅰ:振荡后静置,上层溶液颜色保持不变 |
| B、Ⅱ:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 |
| C、Ⅲ:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 |
| D、Ⅳ:继续煮沸溶液一定能得到氢氧化铁胶体 |
下列关于碳酸钠与碳酸氢钠性质的比较中,正确的是( )
| A、常温时的水溶性:Na2CO3<NaHCO3 |
| B、等物质的量时与足量酸反应产生CO2的量:Na2CO3>NaHCO3 |
| C、与等浓度稀盐酸反应的快慢:Na2CO3<NaHCO3 |
| D、同质量时消耗盐酸的量:Na2CO3<NaHCO3 |
根据对角线原则,Be和Al的化学性质相似,下列说法正确是( )
| A、BeCl2溶液 pH>7,将其蒸干,灼烧后可得到BeCl2晶体 |
| B、BeCl2溶液能导电,说明BeCl2一定是离子化合物 |
| C、Be(OH)2既能溶于盐酸,又能溶于NaOH溶液 |
| D、Be只能与盐酸反应,不能与NaOH溶液反应 |