题目内容
下列离子组能大量共存的是( )
| A、Cu2+、Na+、OH- |
| B、H+、Cl-、CH3COO- |
| C、Fe3+、H+、NO3- |
| D、K+、Ca2+、CO32- |
考点:离子共存问题
专题:离子反应专题
分析:A、Cu2+、OH-离子能够反应生成氢氧化铜,在溶液中不能共存;
B、H+、CH3COO-离子之间能够发生反应生成弱电解质醋酸;
C、Fe3+、H+、NO3-离子之间不满足离子反应发生条件;
D、Ca2+、CO32-离子能够反应生成难溶物碳酸钙,在溶液中不能共存.
B、H+、CH3COO-离子之间能够发生反应生成弱电解质醋酸;
C、Fe3+、H+、NO3-离子之间不满足离子反应发生条件;
D、Ca2+、CO32-离子能够反应生成难溶物碳酸钙,在溶液中不能共存.
解答:
解:A、Cu2+和OH-离子能够发生反应生成难溶物氢氧化铜,在溶液中不能大量共存,故A错误;
B、H+和CH3COO-离子能够反应生成醋酸,所以二者在溶液中不能大量共存,故B错误;
C、Fe3+、H+、NO3-离子不反应,在溶液中能够大量共存,故C正确;
D、Ca2+、CO32-离子之间能够反应生成碳酸钙,在溶液中不能大量共存,故D错误;
故选C.
B、H+和CH3COO-离子能够反应生成醋酸,所以二者在溶液中不能大量共存,故B错误;
C、Fe3+、H+、NO3-离子不反应,在溶液中能够大量共存,故C正确;
D、Ca2+、CO32-离子之间能够反应生成碳酸钙,在溶液中不能大量共存,故D错误;
故选C.
点评:本题考查了离子共存的判断,题目难度中等,注意熟练掌握离子反应的条件,明确常见的离子之间不能共存的情况,特别需要明确发生氧化还原反应、生成络合物的离子的情况.

练习册系列答案
相关题目
在室温下,某溶液中由水电离出的H+浓度为1.0×10-13mol?L-1,则此溶液中一定不可能大量存在的离子组是( )
| A、Mg2+、NO3-、Cl-、Na+ |
| B、Al3+、SO42-、Cl-、K+ |
| C、Na+、Fe2+、SO42-、NO3- |
| D、S2-、SO32-、K+、Na+ |
在pH=2的溶液中,下列各组离子能大量共存的是( )
| A、NH4+、Ca2+、HCO3-、Cl- |
| B、K+、AlO2-、NO3-、I- |
| C、Na+、Cu2+、Br-、SO42- |
| D、Al3+、Fe2+、SO42-、NO3- |
常温下,将一定浓度的某一元酸HA和0.1mol?L-1NaOH溶液等体积混合后,下列说法正确的是( )
| A、若pH=7,HA的浓度一定为0.1 mol?L-1 |
| B、若pH=7,A-的浓度可能小于Na+的浓度 |
| C、若pH<7,溶液中的微粒浓度关系为[Na+]=[HA]+[A-] |
| D、若pH=12,且HA为强酸时,HA的浓度应为0.08 m01.L-1 |
硫酸厂有一辆存放过浓硫酸的铁槽车,某新工人违反操作规程,边吸烟边用水冲洗,结果发生了爆炸事故,下列引起爆炸的原因中正确的是( )
| A、浓硫酸遇明火爆炸 |
| B、铁与水反应生成氢气,接触空气后与明火爆炸 |
| C、浓硫酸遇水发热爆炸 |
| D、稀释后的硫酸与铁反应生成氢气,接触空气遇明火爆炸 |
常温下,下列溶液中各组离子一定大量共存的是( )
| A、使甲基橙呈红色的溶液中:Na+、AlO2-、NO3-、CO32- |
| B、c(ClO-)=1.0 mol?L-1溶液:Na+、SO32-、S2-、Cl- |
| C、含有0.1 mol?L-1 HCO3-的溶液:Na+、Fe3+、NO3-、C6H5O- |
| D、c(OH-)=0.1 mol?L-1的溶液:Na+、K+、CO32-、NO3- |
实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是( )
A、 可用于分离苯和硝基苯的混合物 |
B、 可用于吸收HCl气体.并防止倒吸 |
C、 可用于以NH4Cl为原料,实验室制取NH3 |
D、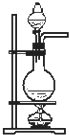 可用于实验室制取乙烯 |
