题目内容
下列物质的电子式书写正确的是( )
A、Na2O2  |
B、H2S  |
C、H2O2  |
D、N2  |
考点:电子式
专题:化学用语专题
分析:A.过氧化钠为离子化合物,钠离子不能合并,应该分别写在过氧根离子的两边;
B.硫化氢为共价化合物,分子中不存在阴阳离子;
C.双氧水为共价化合物,氧原子最外层达到8电子稳定结构;
D.氮气分子中存在氮氮三键,氮氮三键的表示方法错误,且漏掉了氮原子的1对孤电子对.
B.硫化氢为共价化合物,分子中不存在阴阳离子;
C.双氧水为共价化合物,氧原子最外层达到8电子稳定结构;
D.氮气分子中存在氮氮三键,氮氮三键的表示方法错误,且漏掉了氮原子的1对孤电子对.
解答:
解:A.过氧化钠属于离子化合物,钠离子不能合并,过氧化钠正确的电子式为: ,故A错误;
,故A错误;
B.硫化氢分子中不存在阴阳离子,不能标出电荷,硫化氢的电子式为: ,故B错误;
,故B错误;
C.双氧水中存在两个氧氢键和1个O-O键,两个氧原子最外层都为8个电子,双氧水的电子式为: ,故C正确;
,故C正确;
D.氮气分子中,氮原子最外层为8个电子,氮气正确的电子式为: ,故D错误;
,故D错误;
故选C.
 ,故A错误;
,故A错误;B.硫化氢分子中不存在阴阳离子,不能标出电荷,硫化氢的电子式为:
 ,故B错误;
,故B错误;C.双氧水中存在两个氧氢键和1个O-O键,两个氧原子最外层都为8个电子,双氧水的电子式为:
 ,故C正确;
,故C正确;D.氮气分子中,氮原子最外层为8个电子,氮气正确的电子式为:
 ,故D错误;
,故D错误;故选C.
点评:本题考查电子式的书写,难度不大,注意掌握电子式的概念及表示方法,明确电子式的书写方法:简单阳离子的电子式为其离子符合,复杂的阳离子电子式除应标出共用电子对、非共用电子对等外,还应加中括号,并在括号的右上方标出离子所带的电荷;无论是简单阴离子,还是复杂的阴离子,都应标出电子对等,还应加中括号,并在括号的右上方标出离子所带的电荷.

练习册系列答案
相关题目
若某基态原子的外围电子排布式为3d14s2,则下列说法正确的是( )
| A、该元素基态原子中存在电子的原子轨道共有2个 |
| B、该元素原子核外有4个电子层 |
| C、该元素原子中运动状态不同的电子共有21种 |
| D、该元素原子M电子层共有18个电子 |
98%的浓H2SO4,ρ=1.84g/cm3,其物质的量浓度是( )
| A、0.25mol/L |
| B、18.4mol/L |
| C、1.84mol/L |
| D、1.0mol/L |
物质的量相同的NH3和CH4两种气体,一定具有相同的( )
| A、体积 | B、质量 |
| C、原子个数 | D、质子数 |
在恒温密闭容器中进行如下反应:P(g)+Q(g)?R(g)+S(g),下列说法中可以表明该反应已达到平衡状态的是( )
| A、反应容器内的压强不随时间变化 |
| B、P和S的生成速率相等 |
| C、反应混合气体的平均相对分子质量不随时间变化 |
| D、反应混合气体的密度不随时间变化 |
单晶硅是信息产业中的重要基础材料,下列硅及其化合物的说法正确的是( )
①硅是构成一些岩石和矿物的基本元素
②水泥、玻璃、水晶饰物都是硅酸盐制品
③陶瓷是人类应用很早的硅酸盐材料
④单晶硅常用于制造光导纤维
⑤二氧化硅是沙子、石英的主要成分.
①硅是构成一些岩石和矿物的基本元素
②水泥、玻璃、水晶饰物都是硅酸盐制品
③陶瓷是人类应用很早的硅酸盐材料
④单晶硅常用于制造光导纤维
⑤二氧化硅是沙子、石英的主要成分.
| A、①③⑤ | B、①②④ |
| C、③④⑤ | D、①④⑤ |
下列叙述正确的是( )
| A、95℃纯水的pH<7,说明加热可导致水呈酸性 |
| B、常温下,将pH=3的醋酸溶液稀释至10倍后溶液pH=4 |
| C、常温下,将0.2 mol?L-1的盐酸与等体积水混合后溶液pH=1 |
| D、常温下,将pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合后溶液pH<7 |
一定温度下可逆反应N2(g)+3H2(g)?2NH3(g) 达最大限度的标志是( )
| A、2v(N2)=v(NH3) | ||
| B、v正(N2)=3v正(H2) | ||
C、v正(H2)=
| ||
| D、v(N2):v( H2):v (NH3)=1:3:2 |
下列图示与对应的叙述相符的是( )
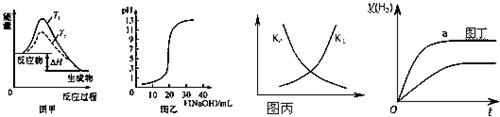

| A、图甲表示温度T1>T2,SO2与O2反应过程中的能量变化 |
| B、图乙表示0.1000mol/L NaOH溶液滴定20.00mL 0.1000mol/L CH3COOH溶液所得到的滴定曲线 |
| C、图丙表示恒容密闭容器中反应“2SO2(g)+O2(g)?2SO3(g)△H<0”的平衡常数K正、K逆随温度的变化 |
| D、图丁表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示CH3COOH溶液 |