题目内容
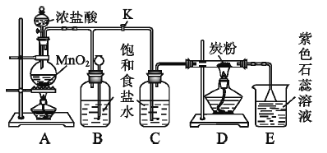
【题目】四甲基氢氧化铵[(CH3)4NOH]是强碱,常温下甲胺(CH3NH2·H2O)的电离常数为Kb,且pKb=-lgKb =3.38。常温下,在体积均为20mL、浓度均为0.1mol·L-1的四甲基氢氧化铵溶液和甲胺溶液,分别滴加浓度为0.1mol·L-1的盐酸,溶液的导电率与盐酸体积的关系如图所示。下列说法正确的是
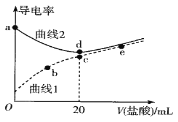
A. 曲线1代表四甲基氢氧化铵溶液
B. 在b、c、e三点中,水的电离程度最大的点是e
C. b点溶液中:c(Cl-)=c(CH3NH3+)+c(CH3NH2·H2O)
D. 常温下,CH3NH3Cl水解常数的数量级为10-11
【答案】D
【解析】
由图示可知,曲线1导电性较弱,说明曲线1对应的溶液为弱电解质,则曲线1代表甲胺;曲线2代表四甲基氢氧化铵[(CH3)4NOH]。据此分析解答。
A.根据分析可知,曲线2代表四甲基氢氧化铵[(CH3)4NOH],曲线1代表的是甲胺,故A错误;
B.c点加入20mL盐酸,甲胺与盐酸恰好完全反应生成CH3NH3C1,CH3NH3+水解,促进了水的电离,则c点水解程度最大,故B错误;
C.c点二者恰好反应生成CH3NH3C1,根据物料守恒,c(Cl-)=c(CH3NH3+)+c(CH3NH2·H2O),而b点加入的HCl较少,根据物料守恒,则c(Cl-)<c(CH3NH3+)+c(CH3NH2·H2O),故C错误;
D.pKb=-lgKb=3.38,则Kb=10-3.38,则CH3NH3C1水解常数Kh=![]() =
=![]() =10-10.62≈2.1×10-11,其数量级为10-11,故D正确;
=10-10.62≈2.1×10-11,其数量级为10-11,故D正确;
答案选D。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
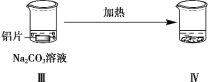
一线名师权威作业本系列答案【题目】探究铝片与Na2CO3溶液的反应,下列说法不正确的是( )
|
| |
无明显现象 | 铝片表面产生细小气泡 | 出现白色浑浊,产生大量气泡(经检验为H2和CO2) |
A.对比Ⅰ、Ⅲ,说明Na2CO3溶液能破坏铝表面的保护膜
B.Na2CO3溶液中存在平衡:CO32-+H2O![]() HCO3- +OH-
HCO3- +OH-
C.加热和H2逸出对CO32-水解平衡移动方向的影响是相反的
D.推测出现白色浑浊的原因:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-
【题目】下列实验中,实验现象及结论都正确且两者具有因果关系的是
实验 | 现象 | 结论 | |
A | 向Ba(NO3)2溶液中通入二氧化硫气体 | 有白色沉淀生成 | SO2与Ba(NO3)2反应得到BaSO3 |
B | 向FeI2的溶液中滴加少量的氯水 | 溶液颜色变深 | Cl2与Fe2+反应生成Fe3+ |
C | 向蔗糖溶液中加几滴稀硫酸,水浴加热5min后,再加新制Cu(OH)2后加热 | 无砖红色沉淀生成 | 蔗糖没有水解 |
D | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
A. A B. B C. C D. D
【题目】2SO2(g) + O2(g) ![]() 2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中,正确的是
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中,正确的是
甲 | 乙 | 丙 | ||
起始物质的量 | n(SO2) / mol | 0.4 | 0.8 | 0.8 |
n(O2) / mol | 0.24 | 0.24 | 0.48 | |
SO2的平衡转化率 / % | 80 | α1 | α2 | |
A. 甲中反应的平衡常数小于乙
B. 平衡时,丙中c(SO3)是甲中的2倍
C. 该温度下,平衡常数值为400
D. 平衡时,甲中O2的转化率大于乙中O2的转化率