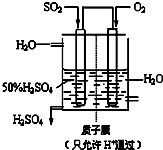
题目内容
(1)一定条件下,5.1 g氨气(NH3)中:
①NH3的物质的量
②所含原子总数是
③所含电子数目与 mL H2O所含电子数相等(![]() =1g/mL)
=1g/mL)
(2)标准状况下O3和CO2的混合气体3.36L,其质量为6.9g,该混合气体的平均摩尔
质量为 ,混合气体中C、O原子个数比为 。
(3)20℃时将9.48 g KNO3溶于30.0 g水中恰好配成密度为1.13 g·cm-3的饱和溶液,则该饱和溶液中的KNO3质量分数为 ,KNO3的物质的量浓度为 。
(1)①0.3 mol ② 1.2NA或7.224×1023 ③ 5.4
(2)46 g/mol 1:5
(3)24% 2.69 mol/L

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目