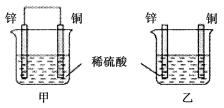
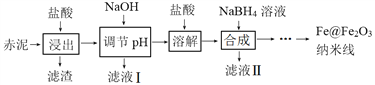
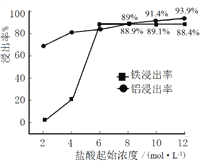
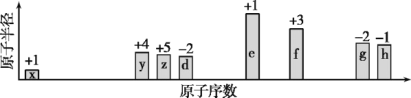
��Ŀ����
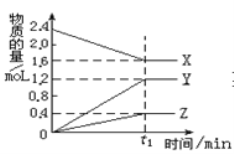
����Ŀ�������ģ�ij�¶��£���2L������3�����ʼ���з�Ӧ�� X��Y��Z�����ʵ�����ʱ��ı仯������ͼ����Ӧ�� t1min ʱ����ƽ�⣬��ͼ��ʾ��
�Ţٸ÷�Ӧ�Ļ�ѧ����ʽ��____________��
�ڸ÷�Ӧ��ƽ�ⳣ����___________��
�� ��t1minʱ���÷�Ӧ�ﵽ��__________״̬�����п���Ϊ�жϷ�Ӧ�Ѵﵽ��״̬����________������ţ���
A��X��Y��Z�ķ�Ӧ������� B��X��Y�����ʵ���Ũ�Ȳ��ٸı�
C������ 3mol Y ��ͬʱ���� 1mol Z D������ 1mol Z ��ͬʱ���� 2mol X
�� ����������Ӧ��X��Y��Z�ֱ�Ϊ NH3 ��H2 ��N2 ������֪1mol�����ֽ�ɵ���������Ҫ����46 kJ������������H2��N2 �ϳ�NH3 ��Ӧ���Ȼ�ѧ��Ӧ����ʽΪ��____________________��
�ڼס�����λͬѧ���۷��ȷ�Ӧ�����ȷ�Ӧ����˵���Ⱥ���ܷ����Ļ�ѧ��Ӧ�����ȷ�Ӧ����˵��Ӧ��Ҫ�������Ȳ��ܽ��еķ�Ӧ�����ȷ�Ӧ������Ϊ����˵����ȷ����__________ͬѧ��
���𰸡�2X![]() 3Y+Z0.0675ƽ��BDN2(g)+3H2(g)
3Y+Z0.0675ƽ��BDN2(g)+3H2(g) ![]() 2NH3(g) ��H= -92kJ / mol��
2NH3(g) ��H= -92kJ / mol��
��������
��1���ٸ���ͼ��XΪ��Ӧ�Y��ZΪ��������ݻ�ѧ������֮�ȵ������ʵ����仯֮�ȣ���˸÷�Ӧ����ʽΪ2X![]() 3Y��Z���ڴﵽƽ��ʱc(X)=1.6/2mol��L��1=0.8mol��L��1��c(Y)=1.2/2mol��L��1=0.6mol��L��1��c(Z)=0.4/2mol��L��1=0.2mol��L��1������ƽ�ⳣ���ı���ʽ��K=0.2��0.63/0.82=0.0675���۸���ͼ����t1ʱ�̷�Ӧ�ﵽƽ�⣻A��û��ָ����Ӧ���ʵķ���A����B�����ݻ�ѧƽ��״̬�Ķ��壬��B��ȷ��C����Ӧ����������Ӧ������У���˲���˵����Ӧ�ﵽƽ�⣬��C����D������1molZ��˵����Ӧ������Ӧ������У�����2molX��˵����Ӧ���淴Ӧ������У�����������ֵ���ڻ�ѧ������֮�ȣ�����ܹ�˵����Ӧ�ﵽƽ�⣬��D��ȷ��
3Y��Z���ڴﵽƽ��ʱc(X)=1.6/2mol��L��1=0.8mol��L��1��c(Y)=1.2/2mol��L��1=0.6mol��L��1��c(Z)=0.4/2mol��L��1=0.2mol��L��1������ƽ�ⳣ���ı���ʽ��K=0.2��0.63/0.82=0.0675���۸���ͼ����t1ʱ�̷�Ӧ�ﵽƽ�⣻A��û��ָ����Ӧ���ʵķ���A����B�����ݻ�ѧƽ��״̬�Ķ��壬��B��ȷ��C����Ӧ����������Ӧ������У���˲���˵����Ӧ�ﵽƽ�⣬��C����D������1molZ��˵����Ӧ������Ӧ������У�����2molX��˵����Ӧ���淴Ӧ������У�����������ֵ���ڻ�ѧ������֮�ȣ�����ܹ�˵����Ӧ�ﵽƽ�⣬��D��ȷ��
��2���ٺϳɰ����ڷ��ȷ�Ӧ������2molNH3ʱ�ų�������Ϊ2��46kJ=92kJ�����ϳɰ����Ȼ�ѧ��Ӧ����ʽΪN2(g)��3H2(g)![]() 2NH3(g) ��H=��92kJ��mol��1������Щ���ȷ�ӦҲ��Ҫ���ȣ������ȷ�Ӧ����˼�ͬѧ˵���������ȷ�Ӧ�dz������Ȳ��ܽ��У�����ͬѧ˵����ȷ��
2NH3(g) ��H=��92kJ��mol��1������Щ���ȷ�ӦҲ��Ҫ���ȣ������ȷ�Ӧ����˼�ͬѧ˵���������ȷ�Ӧ�dz������Ȳ��ܽ��У�����ͬѧ˵����ȷ��