��Ŀ����
����Ŀ��Fe@Fe2O3��������һ�������������ϣ��ڴ�������ҽҩ��������ѧ��������й���Ӧ��ǰ����ij�о�С���Գ��ࣨ��������ȡ�����������в����Ĺ���������SiO2��Fe2O3��Al2O3��Ϊԭ�ϣ�������������Ʊ�Fe@Fe2O3�����߲�̽������ˮ�����е�Ӧ�á�
�ش��������⣺
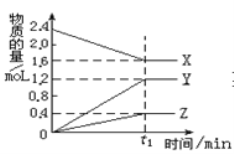
��1����������ʵ���У�������ʼŨ�ȶ������������ʵ�Ӱ����ͼ��ʾ��
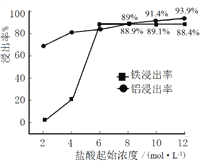
������ĺ���Ũ��Ϊ______________��
��������ʼŨ��Ϊ2 mol��L��1ʱ�����Ľ����ʺܵͣ�ԭ����______________��
��2����֪��25��ʱ��Al(OH)3(s)![]() AlO2��+ H+ + H2O K=4��10��13��������Һc(Al3+) = 0.04 mol��L��1��������pH��ʱ��pH��СӦΪ______________�������pH��������Һ������䣩��
AlO2��+ H+ + H2O K=4��10��13��������Һc(Al3+) = 0.04 mol��L��1��������pH��ʱ��pH��СӦΪ______________�������pH��������Һ������䣩��
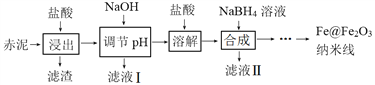
��3��Fe@Fe2O3������Ϊ�Dz�ṹ������Fe������Fe2O3�������������������ںϳɹ����б��������γɡ�
�١��ϳɡ�ʱ�μ�NaBH4��Һ�����а������ݲ�������Һ���к�B(OH)3���ϳ����˵����ӷ���ʽΪ____________________________��
�ڡ��ϳɡ������ˡ�______________��______________���Fe@Fe2O3�����ߡ�
��4��Fe@Fe2O3������ȥ��ˮ����Cr2O72���Ļ����ǣ������߽�Cr2O72�������ڱ��沢��ԭ���ڡ��������͡������������½������߷ֱ�����������ͬ��ˮ���У�80 min����ո������ߣ���������Ԫ�ص�ԭ�Ӹ��������±���

����ˮ����Fe@Fe2O3�������γɵķ�ɢϵ��____________________________��
������2��ʵ��������______________���������������������
����֪ˮ���м�ⲻ��Cr(��)������1��Fe@Fe2O3�����ߵı���Cr(��)��ȥ����Ϊ____________________________��
���𰸡� 6 mol��L��1 ������ʼŨ��Ϊ2mol��L��1ʱ��Fe3+������ˮ�� 11 9H2O + 4Fe3+ + 3BH4�� = 4Fe + 6H2��+ 3B(OH)3 + 9H+ ϴ�� ��� ���� ���� 46.8%
����������1������ͼ����Ϣ��֪�������Ũ��Ϊ6 mol��L��1ʱ�������Ľ������Ѿ��ܸߣ�������Ũ�Ƚ������������ԣ��ʺ���Ũ��Ϊ6 mol��L��1����������ʼŨ��Ϊ2mol��L��1ʱ��Fe3+������ˮ�⣬���Ľ����ʺܵͣ���2����֪��25��ʱ��Al(OH)3(s)![]() AlO2��+ H+ + H2O K=c(AlO2��)c(H+)= c(Al3+)c3(OH-)=4��10��13��������Һc(Al3+) = 0.04 mol��L��1����Ksp[Al(OH)3]=c(Al3+)c3(OH-)= 0.4 mol��L��1��c3(OH-)=4��10��13��c(OH-)=10��3��������pH��ʱ��pH��СӦΪ11����3���١��ϳɡ�ʱ�μ�NaBH4��Һ�����а������ݲ���Ϊ��������Һ���к�B(OH)3���ϳ����˵����ӷ���ʽΪ9H2O + 4Fe3+ + 3BH4�� = 4Fe + 6H2��+ 3B(OH)3 + 9H+��
AlO2��+ H+ + H2O K=c(AlO2��)c(H+)= c(Al3+)c3(OH-)=4��10��13��������Һc(Al3+) = 0.04 mol��L��1����Ksp[Al(OH)3]=c(Al3+)c3(OH-)= 0.4 mol��L��1��c3(OH-)=4��10��13��c(OH-)=10��3��������pH��ʱ��pH��СӦΪ11����3���١��ϳɡ�ʱ�μ�NaBH4��Һ�����а������ݲ���Ϊ��������Һ���к�B(OH)3���ϳ����˵����ӷ���ʽΪ9H2O + 4Fe3+ + 3BH4�� = 4Fe + 6H2��+ 3B(OH)3 + 9H+��
�ڡ��ϳɡ������ˡ�ϴ�ӡ���ɻ��Fe@Fe2O3�����ߣ���4������ˮ����Fe@Fe2O3�������γɵķ�ɢϵ�ǽ��������ɱ������ݿ�֪��Fe:O:Cr=5.2:16.7:1����CrΪ1mol�������Cr2O72����֪����3.5mol��ʣ�����Ϊ16.7-3.5=13.2mol������Ϊ�������е���������![]() ���������Ϊ5.2mol���ʲ����ϣ���Ӧ���в����������������еģ�������2��ʵ������������������֪ˮ���м�ⲻ��Cr(��)�����������и�Ԫ�صĺ���������1��Fe@Fe2O3�����ߵı���Cr(��)��ȥ����Ϊ
���������Ϊ5.2mol���ʲ����ϣ���Ӧ���в����������������еģ�������2��ʵ������������������֪ˮ���м�ⲻ��Cr(��)�����������и�Ԫ�صĺ���������1��Fe@Fe2O3�����ߵı���Cr(��)��ȥ����Ϊ ��
��

 ȫ�ŵ�����Ԫ�ƻ�ϵ�д�
ȫ�ŵ�����Ԫ�ƻ�ϵ�д�����Ŀ������ˮ��ɽ���ǽ�ɽ��ɽ�����о�NO2��NO��CO��NO2- �ȴ�����Ⱦ���ˮ��Ⱦ��Ĵ����Խ��������й�������Ҫ���塣
��1����֪����NO2 + CO ![]() CO2 + NO �÷�Ӧ��ƽ�ⳣ��ΪK1����ͬ��
CO2 + NO �÷�Ӧ��ƽ�ⳣ��ΪK1����ͬ��
ÿ1mol�������ʷֽ�Ϊ��̬��̬ԭ�����������ֱ�Ϊ
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
��N2(g)+O2(g) ![]() 2NO(g) ��H��+179.5 kJ/mol K2
2NO(g) ��H��+179.5 kJ/mol K2
��2NO(g) +O2(g)![]() 2NO2(g) ��H��-112.3 kJ/mol K3
2NO2(g) ��H��-112.3 kJ/mol K3
��д��NO��CO��Ӧ��������Ⱦ��������Ȼ�ѧ����ʽ____________________________�Լ����Ȼ�ѧ����ʽ��ƽ�ⳣ��K=____________����K1��K2��K3��ʾ��
��2����Ⱦ������NO2��CO��һ�������µķ�ӦΪ��2NO2+4CO![]() 4CO2+N2��ij�¶��£���1L�ܱ������г���0.1mol NO2��0.2mol CO����ʱ������ѹǿΪ1������ѹ��5��ʱ��Ӧ�ﵽƽ��ʱ��������ѹǿ��Ϊԭ����
4CO2+N2��ij�¶��£���1L�ܱ������г���0.1mol NO2��0.2mol CO����ʱ������ѹǿΪ1������ѹ��5��ʱ��Ӧ�ﵽƽ��ʱ��������ѹǿ��Ϊԭ����![]() ����Ӧ��ʼ��ƽ��ʱCO��ƽ����Ӧ����v(CO)=________��
����Ӧ��ʼ��ƽ��ʱCO��ƽ����Ӧ����v(CO)=________��
�����¶��£�ijʱ�̲��NO2��CO��CO2��N2��Ũ�ȷֱ�Ϊamol/L��0.4mol/L��0.1mol/L��1mol/L��Ҫʹ��Ӧ���淴Ӧ������У�a��ȡֵ��Χ________________��
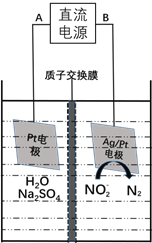
��3���绯ѧ����NO2-��ԭ������ͼ��
����Դ�ĸ�����____________����A��B��������ӦʽΪ________________��
������������ת����6mol���ӣ���Ĥ������Һ�������仯��![]() Ϊ_____g��
Ϊ_____g��