题目内容
出土的锡青铜(铜锡合金)文物常有Cu2(OH)3Cl覆盖在其表面.下列说法不正确的是( )
| A、锡青铜的熔点比纯铜低 |
| B、在自然环境中,锡青铜中的锡对铜起保护作用 |
| C、锡青铜文物在潮湿环境中的腐蚀比干燥环境中快 |
| D、化合物Cu2(OH)3Cl中Cu、Cl的化合价均为+1 |
考点:铜金属及其重要化合物的主要性质,合金的概念及其重要应用
专题:几种重要的金属及其化合物
分析:A.合金的硬度大,熔点低;
B.较活泼的金属能保护较不活泼的金属;
C.构成原电池能加快金属的腐蚀;
D.根据化合价代数和为0判断.
B.较活泼的金属能保护较不活泼的金属;
C.构成原电池能加快金属的腐蚀;
D.根据化合价代数和为0判断.
解答:
解:A.锡青铜属于合金根据合金的特性,熔点比任何一种纯金属的低,故A正确;
B.由于锡比铜活泼,故在发生电化学腐蚀时,锡失电子保护铜,故B正确;
C.潮湿的环境将会加快金属的腐蚀速率,故C正确;
D.化合物Cu2(OH)3Cl中Cl为-1价、O为-2价、H为+1价,则铜为+2价,故D错误;
故选D.
B.由于锡比铜活泼,故在发生电化学腐蚀时,锡失电子保护铜,故B正确;
C.潮湿的环境将会加快金属的腐蚀速率,故C正确;
D.化合物Cu2(OH)3Cl中Cl为-1价、O为-2价、H为+1价,则铜为+2价,故D错误;
故选D.
点评:本题考查合金的性质及影响金属的腐蚀速率的因素,为高频考点,侧重学生的分析能力的考查,注意原电池反应加快化学反应速率.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
有a、b、c、d、e五种金属.已知(1)e的氧化产物比d的氧化产物氧化能力强;(2)a投入e的盐溶液中可得e的单质,而c投入e的盐溶液中却不能可得e的单质;(3)在以a、d为极板形成的原电池中(电解质溶液是稀硫酸),d极上发生还原反应;(4)电解含有a、b、c、e阳离子的盐溶液时,b离子最先在电极上放电,然后是e离子,a、c两种离子则不能在电极上放电;(5)c的单质与硫酸铜溶液反应可生产蓝色沉淀.推知五种金属的活动顺序为( )
| A、a、d、b、e、c |
| B、c、a、d、e、b |
| C、a、e、d、b、c |
| D、c、a、b、e、d |
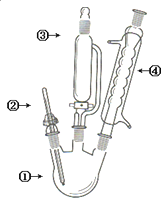 高中化学选修5《有机化学基础》第64页,有这样一个有机合成的装置图,有关下列仪器的名称和作用的叙述不正确的是( )
高中化学选修5《有机化学基础》第64页,有这样一个有机合成的装置图,有关下列仪器的名称和作用的叙述不正确的是( )| A、①三口烧瓶,用作反应器 |
| B、②为温度计,用于测量反应混合物的温度 |
| C、③为长颈漏斗,用于反应过程中添加反应液体 |
| D、④球形冷凝管,起冷凝、回流的作用,其冷水的进口在下方 |
某溶液中含有两种溶质NaCl和H2SO4,它们的物质的量之比为3:1.用石墨做电极电解该混合溶液时,根据电极产物,可明显分为三个阶段,下列叙述不正确的是( )
| A、阴极自始至终只有H2 |
| B、阳极先析出Cl2后析出O2 |
| C、电解最后阶段为电解水 |
| D、溶液pH不断增大,最后为7 |
 ,从A出发发生图示中的一系列反应,其中B和C按1:2反应生成Z,F和E按1:2反应生成W,W和Z互为同分异构体.
,从A出发发生图示中的一系列反应,其中B和C按1:2反应生成Z,F和E按1:2反应生成W,W和Z互为同分异构体.








