题目内容
(10分)某化学兴趣小组的同学为了探究铝电极在电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| 1 | Mg、Al | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
| 4 | Mg、Al | 氢氧化钠溶液 | 偏向Mg |
| 5 | Al、Zn | 浓硝酸 | 偏向Al |
(1)实验1和2中Al所作的电极(正极或负极) (填“相同”或“不相同”)。
(2)实验3中负极反应式: ;总反应的离子方程式: 。
(3)实验4中铝作 极,电极反应式: 。
(4)解释实验5中电流计指针偏向铝的原因 。
(1)不相同 (2)Al-3e-=Al3+;2Al+6H+=2Al3++3H2↑
(3)负; Al-3e-+4OH-=AlO2-+2H2O
(4)Al虽比Zn活泼,但常温下,Al遇浓硝酸发生钝化,故Al为正极,指针偏向Al。
解析试题分析:(1)在验1中由于活动性Mg>Al,所以Mg作负极,Al作正极;在实验2中由于活动性Al>Cu。Al作负极,Cu作正极,所以这两个实验中的Al所作的电极不相同。(2)在实验3中Al为负极,电极反应式为Al-3e-=Al3+;正极的电极式为2H++2e-=H2↑。所以总反应的离子方程式:2Al+6H+=2Al3++3H2↑。(3)在实验4中由于Mg不能与NaOH溶液发生反应,而铝能发生反应。所以Al作原电池的负极。电极反应式是Al-3e-+4OH-=AlO2-+2H2O。(4)在解释实验5中由于在室温下Al在浓硝酸中会发生钝化现象。所以Al作正极,Zn作负极。所以电流计指针偏向正极铝。
考点:考查铝电极在原电池电池中的作用的知识。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
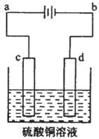
某小组同学以碳棒为电极电解CuCl2溶液时,发现阴极碳棒上除了有红色物质析出外,还有少量白色物质析出。为探究阴极碳棒上的产物,同学们阅读资料并设计了如下过程:
Ⅰ.有关资料:铜的化合物颜色性质如下
| 物质 | 颜色、性质 | 物质 | 颜色、性质 |
| 氢氧化铜Cu(OH)2 | 蓝色固体不溶于水 | 硫酸铜(CuSO4) | 溶液呈蓝色 |
| 氧化亚铜(Cu2O) | 红色固体不溶于水 | 氯化铜(CuCl2) | 浓溶液呈绿色,稀溶液呈蓝色 |
| 氯化亚铜(CuCl) | 白色固体不溶于水 | 碱式氯化铜 | 绿色固体不溶于水 |
Ⅱ.探究实验:
(1)提出假设
①红色物质一定有铜,还可能有Cu2O;
②白色物质为铜的化合物,其化学式可能为__________________________。
(2)实验验证
取电解CuCl2溶液后的阴极碳棒,洗涤、干燥,连接下列装置进行实验,验证阴极产物,

①实验前,检查装置A气密性的方法是_______________________________。
②实验时,各装置从左至右的连接顺序为A→________→________→B→________→________。
(3)观察现象,得出结论
实验结束后,碳棒上的白色物质变为红色,F中物质不变色,D中出现白色沉淀,根据现象①碳棒上的红色物质是否有Cu2O________(填“是”或“否”),理由是________________________________________________________;
②装置________(填上图中装置编号)中________的现象说明提出假设②中的白色物质一定存在;
③写出装置B中发生反应的化学方程式___________________________ _。
(4)问题讨论
①电解CuCl2溶液后的阴极上发生的反应为:______________________
和_______________________________________________________________;
②实验过程中,若装置B中的空气没有排净就开始加热,可能对实验造成的影响是__________________________________________________________。
现有乙酸、乙烯和丙烯(C3H6)的混合物,其中氧的质量分数为a,则碳的质量分数是( )
A. | B. | C. | D. |
满足分子式为C3H4ClBr不含有环的有机物共有
| A.6种 | B.7种 | C.8种 | D.9种 |




 2CO2(g)+ N2(g)△H <0
2CO2(g)+ N2(g)△H <0
 N2O4(g) △H=-56.9 kJ/mol ②
N2O4(g) △H=-56.9 kJ/mol ②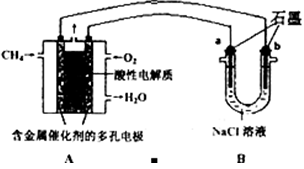
 Zn电池,它用不锈钢制成一个由正极壳和负极盖组成的小圆盒,盒内靠正极壳一端填充Ag2O和少量石墨组成的正极活性材料,负极盖一端填充Zn
Zn电池,它用不锈钢制成一个由正极壳和负极盖组成的小圆盒,盒内靠正极壳一端填充Ag2O和少量石墨组成的正极活性材料,负极盖一端填充Zn