题目内容
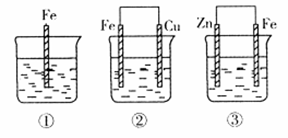
Ⅰ.在下图的装置中,属于原电池的是 。
Ⅱ.(1)如图所示,烧杯中为CuCl2溶液,在图中画出必要的连线或装置,使连接后的装置为原电池。电极反应方程式:
铁板: ;碳棒: 。
(2)铜片、锌片连接后浸入稀硫酸中构成原电池,当导线上通过3.01×1022个电子时,锌片质量减少________g。铜片表面析出氢气_________L(标准状况)。
Ⅰ.D、F、G Ⅱ.(1)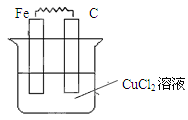 Fe-2e-=Fe2+ Cu2++2e-=Cu
Fe-2e-=Fe2+ Cu2++2e-=Cu
(2)1.625g 0.56L
解析试题分析:Ⅰ.原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应,据此可知:
A、该装置只有一个电极材料,所以不能形成原电池;
B、该装置只有一个电极材料,且石墨和电解质溶液不能自发的进行氧化还原反应,所以不能形成原电池;
C、两电极材料相同,所以不能形成原电池,故错误;
D、该装置符合原电池的构成条件,所以能形成原电池,故正确;
E、酒精不是电解质,铁和酒精不能自发的进行氧化还原反应,所以不能形成原电池;
F、该装置符合原电池的构成条件,所以能形成原电池,故正确;
G、该装置符合原电池的构成条件,所以能形成原电池,故正确;
H、该装置两电极间不能构成闭合回路,所以不能形成原电池,所以答案选D、F、G
Ⅱ.(1)原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。铁是活泼的金属,所以铁是负极,碳棒是正极,溶液中的铜离子再正极得到电子,发生还原反应,电极反应式分别是Fe-2e-=Fe2+、Cu2++2e-=Cu。
(2)铜片、锌片连接后浸入稀硫酸中构成原电池,其中锌是负极,铜是正极,电极反应式分别是Zn-2e-=Zn2+、2H++2e-=H2↑。3.01×1022个电子的物质的量是3.01×1022÷6.02×1023/mol=0.05mol,所以锌片质量减少0.025mol×65g/mol=1.625g,铜片表面析出氢气的体积(标准状况下)是0.025mol×22.4L/mol=0.56L。
考点:考查原电池构成条件的判断、电极反应式的书写以及有关计算等
点评:该题是高考中的常见考点,侧重对学生基础知识的巩固和训练。有利于培养学生的逻辑推理能力和规范答题能力。明确原电池的工作原理、构成条件是答题的关键,注意相关知识的积累和总结。

 天天练口算系列答案
天天练口算系列答案(10分)某化学兴趣小组的同学为了探究铝电极在电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| 1 | Mg、Al | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
| 4 | Mg、Al | 氢氧化钠溶液 | 偏向Mg |
| 5 | Al、Zn | 浓硝酸 | 偏向Al |
(1)实验1和2中Al所作的电极(正极或负极) (填“相同”或“不相同”)。
(2)实验3中负极反应式: ;总反应的离子方程式: 。
(3)实验4中铝作 极,电极反应式: 。
(4)解释实验5中电流计指针偏向铝的原因 。
下列最简式中,不需要知道对应物质的相对分子质量即可确定其分子式的是
| A.C3H4 | B.CH | C.CH2 | D.C2H5O |
 4Al+3O2↑
4Al+3O2↑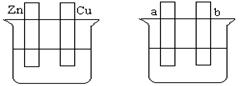
 =-2830kJ·mol-1
=-2830kJ·mol-1


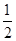 O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1 [Cu(NH3)3]Ac·CO △H<0
[Cu(NH3)3]Ac·CO △H<0
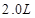 ,
, 溶液,如有
溶液,如有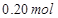 电子发生转移,试回答下列问题:
电子发生转移,试回答下列问题: 的质量是 ,得到
的质量是 ,得到 的体积(标准状况)是 。
的体积(标准状况)是 。 (填“变小”、“变大”或“不变”)
(填“变小”、“变大”或“不变”)