题目内容
 “温室效应”是哥本哈根气候变化大会研究的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决“温室效应”的有效途径.
“温室效应”是哥本哈根气候变化大会研究的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决“温室效应”的有效途径.(1)其中一种途径是将CO2转化成有机物实现碳循环.如:
2CO2(g)+2H2O(l)═C2H4(g)+3O2(g)△H=+1411.0kJ/mol
2CO2(g)+3H2O(l)═C2H5OH(1)+3O2(g)△H=+1366.8kJ/mol
则由乙烯水化制乙醇反应的热化学方程式为
(2)在一定条件下,6H2(g)+2CO2(g)?CH3CH2OH(g)+3H2O(g).
根据上表中数据分析:
| 温度(k) CO2转化率(%)
|
500 | 600 | 700 | 800 | ||
| 1.5 | 45 | 33 | 20 | 12 | ||
| 2 | 60 | 43 | 28 | 15 | ||
| 3 | 83 | 62 | 37 | 22 |
| n(H2) |
| n(CO2) |
②该反应的正反应为
(3)一定条件下,将3molH2和1molCO2两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3H2(g)+CO2(g)?CH3OH(g)+H2O(g).2min末该反应达到平衡,测得CH3OH的浓度为0.2mol/L.下列判断不正确的是
a.该条件下此反应的化学平衡常数表达式为K=
| c(CH3OH)?c(H2O) |
| c3(H2)?c(CO2) |
b.H2的平均反应速率为0.3mol/(L?s)
c.CO2的转化率为60%
d.若混合气体的密度不再改变时,该反应一定达到平衡状态
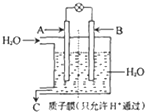
(4)科技人员设想以如图所示装置及电化学原理,将CO2和H2转化为甲醇.若A处通入CO2,B处通入H2,C为CH3OH
①B极为
②A极的电极反应式为
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,已知常温下,其溶解度为1.2×10-3g,则其Ksp为
考点:热化学方程式,化学电源新型电池,化学平衡建立的过程,化学平衡的影响因素
专题:基本概念与基本理论
分析:(1)利用盖斯定律可以计算反应的焓变;
(2)增加氢气的量能够使二氧化碳的转化率增大;升高温度化学平衡向着吸热方向进行;
(3)a、化学平衡常数b、化学反应速率等于单位时间内物质的浓度的变化量;
c、物质的转化率=
×100%,
d、混合气体的密度=
,看分子和分母的变化来判断是否为平衡状态;
(4)失电子的极为负极,燃料电池中燃料作负极,氧气在正极上放电;
(5)根据溶解度的概念结合Ksp表达式进行计算即可.
(2)增加氢气的量能够使二氧化碳的转化率增大;升高温度化学平衡向着吸热方向进行;
(3)a、化学平衡常数b、化学反应速率等于单位时间内物质的浓度的变化量;
c、物质的转化率=
| 变化量 |
| 初始量 |
d、混合气体的密度=
| 混合气体质量 |
| 体积 |
(4)失电子的极为负极,燃料电池中燃料作负极,氧气在正极上放电;
(5)根据溶解度的概念结合Ksp表达式进行计算即可.
解答:
解:(1)根据盖斯定律,乙烯水化制乙醇的反应应是2CO2(g)+3H2O(l)═C2H5OH(1)+3O2(g)△H=+1366.8kJ/mol
和2CO2(g)+2H2O(l)═C2H4(g)+3O2(g)△H=+1411.0kJ/mol的差,故C2H4(g)+H2O(l)═C2H5OH(l)△H=-44.2 kJ/mol,
故答案为:C2H4(g)+H2O(l)═C2H5OH(l)△H=-44.2 kJ/mol;
(2)①温度一定时,提高氢碳比[n(H2)/n(CO2)],相当于增加氢气的量,增加氢气的量能够使二氧化碳的转化率增大,故答案为:增大;
②从表中数据看出:温度越高,二氧化碳的转化率越小,升高温度化学平衡向着吸热方向,即向着使二氧化碳的转化率减小的方向(逆向)进行,故正向是放热反应,故答案为:放;
(3)a、化学平衡常数=
(固体和纯溶剂不列入表达式中)=
,故a正确;
b、H2的平均反应速率=
=0.3mol/(l?min),而不是3mol/(l?s),选项单位错误,故B错误;
c、甲醇的浓度为0.2mol/L,生成的物质的量为0.4mol,则消耗掉的二氧化碳为0.4mol,所以二氧化碳物质的转化率=
×100%=
×100%=40%,故c错误;
d、混合气体的密度=
,混合气体的质量遵循质量守恒,任何状态下质量均是定值,此反应又是在固定容积为2L的密闭容器中发生,所以体积在任何状态下均是定值,所以密度在任何状态下均是定值,故d错误,故答案为:bcd;
(4)①根据燃料电池的结构示意图A处通入CO2,B处通入H2,可以知道B极为失去电子的极,失电子的极为负极,在燃料电池中燃料氢气作负极,故答案为:负;
②氧气在正极上得电子,在酸性介质下,二氧化碳得电子的还原反应为:CO2+6H++6e-=CH3OH+H2O,故答案为:CO2+6H++6e-=CH3OH+H2O;
(5)因为常温时,碳酸钙的溶解度为1.2×10-3g,则100克水形成饱和碳酸钙溶液的质量=100g+1.2×10-3g≈100g,稀溶液的密度=1g/ml,100克水形成饱和碳酸钙溶液的体积=
=100ml=0.1L,溶液中钙离子的物质的量=溶液中碳酸根离子的物质的量=溶解碳酸钙的物质的量=
=1.2×10-5mol,溶液中含C(Ca2+)=C(CO32-)=
=1.2×10-4mol/L,则其Ksp=1.2×10-4mol/L×1.2X10-4mol/L=1.44×10-8mo1/L,故答案为:1.44×10-8mo1/L.
和2CO2(g)+2H2O(l)═C2H4(g)+3O2(g)△H=+1411.0kJ/mol的差,故C2H4(g)+H2O(l)═C2H5OH(l)△H=-44.2 kJ/mol,
故答案为:C2H4(g)+H2O(l)═C2H5OH(l)△H=-44.2 kJ/mol;
(2)①温度一定时,提高氢碳比[n(H2)/n(CO2)],相当于增加氢气的量,增加氢气的量能够使二氧化碳的转化率增大,故答案为:增大;
②从表中数据看出:温度越高,二氧化碳的转化率越小,升高温度化学平衡向着吸热方向,即向着使二氧化碳的转化率减小的方向(逆向)进行,故正向是放热反应,故答案为:放;
(3)a、化学平衡常数=
| 各生成物平衡浓度系数次方的乘积 |
| 各反应物平衡浓度系数次方的乘积 |
| c(CH3OH)?c(H2O) |
| c3(H2)?c(CO2) |
b、H2的平均反应速率=
| △c(H2) |
| △t |
c、甲醇的浓度为0.2mol/L,生成的物质的量为0.4mol,则消耗掉的二氧化碳为0.4mol,所以二氧化碳物质的转化率=
| 变化量 |
| 初始量 |
| 0.4mol |
| 1mol |
d、混合气体的密度=
| 混合气体质量 |
| 体积 |
(4)①根据燃料电池的结构示意图A处通入CO2,B处通入H2,可以知道B极为失去电子的极,失电子的极为负极,在燃料电池中燃料氢气作负极,故答案为:负;
②氧气在正极上得电子,在酸性介质下,二氧化碳得电子的还原反应为:CO2+6H++6e-=CH3OH+H2O,故答案为:CO2+6H++6e-=CH3OH+H2O;
(5)因为常温时,碳酸钙的溶解度为1.2×10-3g,则100克水形成饱和碳酸钙溶液的质量=100g+1.2×10-3g≈100g,稀溶液的密度=1g/ml,100克水形成饱和碳酸钙溶液的体积=
| 100g |
| 1g/mL |
| 1.2×10-3g |
| 100g/mol |
| 1.2×10-5mol |
| 0.1L |
点评:本题综合考查了学生有关热化学、电化学、化学反应平衡的移动以及溶液中的溶解度和Ksp之间的关系知识,属于知识的迁移和应用题方面的题目,难度大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列离子方程式书写正确的是( )
| A、氯化钡溶液与稀硫酸混合:Ba2++SO42-=BaSO4↓ |
| B、铁与盐酸反应:2Fe+6H+=2Fe3++3H2↑ |
| C、氢氧化钡与硫酸铜溶液混合:2OH-+Cu2+=Cu(OH)2↓ |
| D、氢氧化钡溶液与稀硫酸混合:Ba2++SO42-=BaSO4↓ |
 普通水泥在固化过程中自由水分子减少,并且溶液呈碱性.根据这一物理化学特点,科学家发明了电动势法测水泥初凝时间.此法的原理如图所示,反应的总方程式为:2Cu+Ag2O=Cu2O+2Ag,下列有关说法正确的是( )
普通水泥在固化过程中自由水分子减少,并且溶液呈碱性.根据这一物理化学特点,科学家发明了电动势法测水泥初凝时间.此法的原理如图所示,反应的总方程式为:2Cu+Ag2O=Cu2O+2Ag,下列有关说法正确的是( )| A、工作时,负极周围海水的pH增大 |
| B、测量原理示意图中,Ag2O为负极 |
| C、负极的电极反应式为:2Cu+2OH--2e-=Cu2O+H2O |
| D、电池工作时,OH-向正极移动 |
 和
和 D、35Cl和37Cl E、乙醇和乙二醇
D、35Cl和37Cl E、乙醇和乙二醇