题目内容
有一块铁的“氧化物”样品,用140 mL 5.0 mol·L-1盐酸恰好将之完全溶解,所得溶液还能吸收0.025 mol Cl2,恰好使其中的Fe2+全部转变为Fe3+,则该样品可能的化学式为( )
A.Fe2O3 B.Fe3O4 C.Fe4O5 D.Fe5O7
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.下列化学式能真实表示物质分子组成的是( )
| A. | NaOH | B. | SiO2 | C. | MgCl2 | D. | CO2 |
7.过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等.某化学兴趣小组取一定量的过氧化氢溶液,探究了过氧化氢的性质,并准确测定了过氧化氢的含量.
Ⅰ.探究过氧化氢的性质
(1)该化学小组设计了两个实验,分别证明了H2O2的两个性质.请将他们的实验现象和验证性质填入下表:
(2)常温下,向H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:
2Fe2++H2O2+2H+=2Fe3++2H2O,2Fe3++H2O2=2Fe2++O2↑+2H+下列说法正确的是ACD
A.H2O2的氧化性比Fe3+强,其还原性比Fe2+强
B.在H2O2分解过程中,溶液的pH逐渐下降
C.在H2O2分解过程中,Fe2+和Fe3+的总量发生变化
D.H2O2生产过程要严格避免混入Fe2+
Ⅱ.测定过氧化氢的含量
(1)量取10.00mL密度为ρ g/mL的过氧化氢溶液,溶解后将溶液转移至250mL容量瓶(填仪器名称)中,加水稀释至刻度,摇匀.移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样.
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里.□MnO4-+□H2O2+□H+=□Mn2++□H2O+□□
该反应体现了H2O2的还原性.
(3)滴定时,将高锰酸钾标准溶液注入酸式 (填“酸式”或“碱式”)滴定管中.滴定到达终点的现象是滴入一滴高锰酸钾溶液,溶液呈浅红色,且30秒内不褪色.
(4)反复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为$\frac{0.085cV}{ρ}$.
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果偏高(填“偏高”或“偏低”或“不变”).
Ⅰ.探究过氧化氢的性质
(1)该化学小组设计了两个实验,分别证明了H2O2的两个性质.请将他们的实验现象和验证性质填入下表:
| 实验所用试剂或操作 | 实 验 现 象 | 验证的性质 |
| 碘化钾淀粉溶液 | ||
| 取适量过氧化氢溶液于试管中,加热,用带火星的木条检验. |
2Fe2++H2O2+2H+=2Fe3++2H2O,2Fe3++H2O2=2Fe2++O2↑+2H+下列说法正确的是ACD
A.H2O2的氧化性比Fe3+强,其还原性比Fe2+强
B.在H2O2分解过程中,溶液的pH逐渐下降
C.在H2O2分解过程中,Fe2+和Fe3+的总量发生变化
D.H2O2生产过程要严格避免混入Fe2+
Ⅱ.测定过氧化氢的含量
(1)量取10.00mL密度为ρ g/mL的过氧化氢溶液,溶解后将溶液转移至250mL容量瓶(填仪器名称)中,加水稀释至刻度,摇匀.移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样.
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里.□MnO4-+□H2O2+□H+=□Mn2++□H2O+□□
该反应体现了H2O2的还原性.
(3)滴定时,将高锰酸钾标准溶液注入酸式 (填“酸式”或“碱式”)滴定管中.滴定到达终点的现象是滴入一滴高锰酸钾溶液,溶液呈浅红色,且30秒内不褪色.
(4)反复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为$\frac{0.085cV}{ρ}$.
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果偏高(填“偏高”或“偏低”或“不变”).


 .
. ①中引发铝热反应的实验操作是_____________,产物中的单质B是_____________。
①中引发铝热反应的实验操作是_____________,产物中的单质B是_____________。
 氨水与SO2反应后溶液中的铵盐:
氨水与SO2反应后溶液中的铵盐: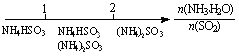
 00 mL H2S饱和溶液中通入SO2气体,所得溶液pH变化如图中曲线所示。下列分析正确的是
00 mL H2S饱和溶液中通入SO2气体,所得溶液pH变化如图中曲线所示。下列分析正确的是