题目内容
 一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,1 100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示.
一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,1 100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示.(1)该反应的平衡常数表达式K=
(2)下列措施中能使平衡时K增大的是
A.升高温度B.增大压强C.充入一定量COD.降低温度
(3)8分钟内,CO的平均反应速率v(CO)=
(4)1100℃时,2L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 |
| 反应物投入量 | 3mol Fe、 2mol CO2 | 4mol FeO、 3mol CO |
| CO的浓度(mol?L-1) | c1 | c2 |
| CO2的体积分数 | φ1 | φ2 |
| 体系压强(Pa) | p1 | p2 |
| 气态反应物的转化率 | α1 | α2 |
②求c1=
考点:化学平衡常数的含义
专题:化学平衡专题
分析:(1)依据平衡常数概念写出,用生成物平衡浓度幂次方乘积除以反应物平衡浓度的幂次方乘积得到;
(2)平衡常数随温度变化,结合平衡移动原理分析判断;
(3)8分钟内,一氧化碳难度变化0.5mol/L,依据V=
计算CO的平均反应速率;
(4)Fe(s)+CO2(g)?FeO(s)+CO(g),反应是气体体积不变的吸热反应,依据
①依据图表数据分析,反应前后气体体积不变,加入2molCO2,加入3mol CO,相当于加入3molCO2,的平衡状态,气体物质条件分数相同,物质的量不同,压强不同,气体物质的量大的容器中压强大,起始量不同,平衡浓度、转化率不同;
②依据题干计算平衡常数,结合化学平衡三段式列式计算;
(2)平衡常数随温度变化,结合平衡移动原理分析判断;
(3)8分钟内,一氧化碳难度变化0.5mol/L,依据V=
| △c |
| △t |
(4)Fe(s)+CO2(g)?FeO(s)+CO(g),反应是气体体积不变的吸热反应,依据
①依据图表数据分析,反应前后气体体积不变,加入2molCO2,加入3mol CO,相当于加入3molCO2,的平衡状态,气体物质条件分数相同,物质的量不同,压强不同,气体物质的量大的容器中压强大,起始量不同,平衡浓度、转化率不同;
②依据题干计算平衡常数,结合化学平衡三段式列式计算;
解答:
解:(1)Fe(s)+CO2(g)?FeO(s)+CO(g),依据平衡常数概念书写,注意固体和纯液体不写入表达式,表达式为:K=
;
故答案为:
;
(2)平衡常数随温度变化,不随浓度压强等因素变化,反应是吸热反应,升温平衡时K增大;
A.升高温度,平衡正向进行,平衡常数增大,故A正确;
B.增大压强,平衡不动,平衡常数不变,故B错误;
C.充入一定量CO,平衡逆向进行,但平衡常数不变,故C错误;
D.降低温度,平衡逆向进行,平衡常数减小,故D错误;
故答案为:A;
(3)依据图象分析,8分钟内,一氧化碳浓度变化0.5mol/L,CO的平均反应速率v(CO)=
=0.062 5mol/L?min;
故答案为:0.062 5;
(4)①依据图表数据分析,反应前后气体体积不变,加入2molCO2,加入3mol CO,相当于加入3molCO2,平衡时气体体积分数相同,物质的量不同,压强不同,气体物质的量大的容器中压强大,起始量不同,平衡浓度、转化率不同;
A.达到平衡状态,一氧化碳的浓度关系为:3c1=2c2,故A错误;
B.反应物和生成物都是一种,平衡常数相同,所以达到平衡状态二氧化碳的体积分数相同,φ1=φ2,故B正确;
C.乙容器中气体物质的量大于甲容器,所以达到平衡状态p1<p2,故C正确;
D.起始量不同,甲容器正向进行,乙容器逆向进行,反应前后气体体积不变,气态反应物的转化率不相同,故D错误;
故答案为:BC;
②图象分析反应在1100°C反应的平衡常数K=
=2
甲容器中设反应的二氧化碳浓度为x
Fe(s)+CO2(g)?FeO(s)+CO(g),
起始量(mol/L) 1 0
变化量(mol/L) x x
平衡量(mol/L) 1-x x
K=
=2
x=
mol/L
平衡状态一氧化碳的浓度=
(mol/L)=0.67mol/L,
CO2的体积分数φ1
×100%=
×100%=33.3%;
乙容器中温度和甲容器相同,平衡常数相同,所以二氧化碳的体积分数φ2=φ1 =33.3%;
故答案为:0.67mol?L-1 33.3% 33.3%;
| c(CO) |
| c(CO2) |
故答案为:
| c(CO) |
| c(CO2) |
(2)平衡常数随温度变化,不随浓度压强等因素变化,反应是吸热反应,升温平衡时K增大;
A.升高温度,平衡正向进行,平衡常数增大,故A正确;
B.增大压强,平衡不动,平衡常数不变,故B错误;
C.充入一定量CO,平衡逆向进行,但平衡常数不变,故C错误;
D.降低温度,平衡逆向进行,平衡常数减小,故D错误;
故答案为:A;
(3)依据图象分析,8分钟内,一氧化碳浓度变化0.5mol/L,CO的平均反应速率v(CO)=
| 0.5mol/L |
| 8min |
故答案为:0.062 5;
(4)①依据图表数据分析,反应前后气体体积不变,加入2molCO2,加入3mol CO,相当于加入3molCO2,平衡时气体体积分数相同,物质的量不同,压强不同,气体物质的量大的容器中压强大,起始量不同,平衡浓度、转化率不同;
A.达到平衡状态,一氧化碳的浓度关系为:3c1=2c2,故A错误;
B.反应物和生成物都是一种,平衡常数相同,所以达到平衡状态二氧化碳的体积分数相同,φ1=φ2,故B正确;
C.乙容器中气体物质的量大于甲容器,所以达到平衡状态p1<p2,故C正确;
D.起始量不同,甲容器正向进行,乙容器逆向进行,反应前后气体体积不变,气态反应物的转化率不相同,故D错误;
故答案为:BC;
②图象分析反应在1100°C反应的平衡常数K=
| 0.50 |
| 0.25 |
甲容器中设反应的二氧化碳浓度为x
Fe(s)+CO2(g)?FeO(s)+CO(g),
起始量(mol/L) 1 0
变化量(mol/L) x x
平衡量(mol/L) 1-x x
K=
| x |
| 1-x |
x=
| 2 |
| 3 |
平衡状态一氧化碳的浓度=
| 2 |
| 3 |
CO2的体积分数φ1
| 1-x |
| 1 |
| 1 |
| 3 |
乙容器中温度和甲容器相同,平衡常数相同,所以二氧化碳的体积分数φ2=φ1 =33.3%;
故答案为:0.67mol?L-1 33.3% 33.3%;
点评:本题考查化学平衡影响因素、等效平衡、化学平衡的计算,题目计算量较大,难度较大,关键是构建平衡建立的等效途径.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH值:
下列说法或表达中,正确的是( )
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
| A、少量二氧化碳通入NaClO溶液中:2NaClO+CO2+H2O→Na2CO3+2HClO |
| B、过量的 HCN滴入碳酸钠溶液中 HCN+Na2CO3→NaCN+NaHCO3 |
| C、结合质子能力由强到弱的顺序为:CO32->CN->HCO3->CH3COO- |
| D、常温下电离常数:Ki2(H2CO3)>Ki(C6H5OH)>Ki(HCN) |
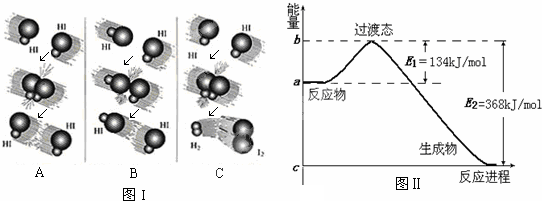



 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H1=-98.32kJ?mol-1
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H1=-98.32kJ?mol-1