题目内容
(1)根据下列离子方程式,写出相应的化学方程式。 (各举一例)
①Ca2+ +CO32- =CaCO3↓;___
②OH- +H+=H2O;____
③CO32-+2H+=H2O+CO2↑;___
(2)完成离子反应,然后改写成化学方程式。
①____+2Ag+=___+2Ag;___
②Fe2O3+____=2Fe3+ +____;____
③CaCO3+____=CO2↑+____+____;_____
①Ca2+ +CO32- =CaCO3↓;___
②OH- +H+=H2O;____
③CO32-+2H+=H2O+CO2↑;___
(2)完成离子反应,然后改写成化学方程式。
①____+2Ag+=___+2Ag;___
②Fe2O3+____=2Fe3+ +____;____
③CaCO3+____=CO2↑+____+____;_____
(1)①CaCl2+Na2CO3=CaCO3↓+2NaCl
②HCl+ NaOH=NaCl+H2O
③Na2CO3+2HCl=2NaCl+H2O+ CO2↑
(2)①Cu、Cu2+ ;Cu+2AgNO3=Cu(NO3)2+2Ag
②6H+ 、3H2O ;Fe2O3+6HCl=2FeCl3+3H2O
③2H+ 、Ca2+ 、H2O ;CaCO3+2HCl=CaCl2+H2O+CO2↑
②HCl+ NaOH=NaCl+H2O
③Na2CO3+2HCl=2NaCl+H2O+ CO2↑
(2)①Cu、Cu2+ ;Cu+2AgNO3=Cu(NO3)2+2Ag
②6H+ 、3H2O ;Fe2O3+6HCl=2FeCl3+3H2O
③2H+ 、Ca2+ 、H2O ;CaCO3+2HCl=CaCl2+H2O+CO2↑

练习册系列答案
相关题目
 价电子(最外层电子)数和重原子(即比氢重的原子)数相同的分子(或离子)互称等电子体.等电子体的结构相似、物理性质相近,称为等电子原理.如N2和CO为等电子体,下表为部分元素等电子体的分类和空间构型表:
价电子(最外层电子)数和重原子(即比氢重的原子)数相同的分子(或离子)互称等电子体.等电子体的结构相似、物理性质相近,称为等电子原理.如N2和CO为等电子体,下表为部分元素等电子体的分类和空间构型表:| 等电子体类型 | 代表物质 | 空间构型 |
| 四原子24电子等电子体 | SO3 | 平面三角形 |
| 四原子26电子等电子体 | SO32- | 三角锥形 |
| 五原子32电子等电子体 | CCl4 | 四面体形 |
| 六原子40电子等电子体 | PCl5 | 三角双锥 |
| 七原子48电子等电子体 | SF6 | 八面体形 |
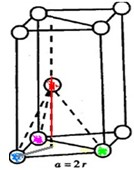 根据上述信息,回答下列问题:
根据上述信息,回答下列问题:(1)写出分子或离子的空间构型:IO3-
(2)由第一、二周期元素组成,与氧化性最强的单质分子互为等电子体的分子有N2H4
(3)如图是六方最密堆积(Be、Mg、Zn)的晶胞图之一,如果金属镁的密度是ρ g/cm3,且假设镁原子是互相接触的刚性小球,
镁的相对原子质量为M,阿伏加德罗常数为NA,则镁原子的半径为
 Ni(CO)4(g) 该反应的△H
Ni(CO)4(g) 该反应的△H
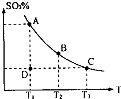 (1)在硫酸生产中,SO2催化氧化生成SO3是反应的关键,其反应的化学方程式为:2SO2(g)+O2(g)?2SO2(g),反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题:
(1)在硫酸生产中,SO2催化氧化生成SO3是反应的关键,其反应的化学方程式为:2SO2(g)+O2(g)?2SO2(g),反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题:
