题目内容
下列实验过程中,始终无明显现象的是( )
| A、SO2通人BaCl2溶液中 |
| B、NO2通入FeSO4溶液中 |
| C、过量CO2通入NaAlO2溶液中 |
| D、SO2通入盐酸酸化的Ba(NO3)2溶液中 |
考点:二氧化硫的化学性质,氮的氧化物的性质及其对环境的影响
专题:元素及其化合物
分析:A.盐酸的酸性大于亚硫酸;
B.二氧化氮和水反应生成硝酸,硝酸能将亚铁离子氧化为铁离子;
C.二氧化碳和偏铝酸钠反应生成氢氧化铝沉淀;
D.二氧化硫和硝酸溶液反应生成硫酸,硫酸和硝酸钡发生复分解反应.
B.二氧化氮和水反应生成硝酸,硝酸能将亚铁离子氧化为铁离子;
C.二氧化碳和偏铝酸钠反应生成氢氧化铝沉淀;
D.二氧化硫和硝酸溶液反应生成硫酸,硫酸和硝酸钡发生复分解反应.
解答:
解:A.盐酸的酸性大于亚硫酸,所以SO2和BaCl2不反应,所以始终没有现象,故A正确;
B.NO2和水反应生成硝酸,硝酸能将亚铁离子氧化为铁离子,所以溶液由浅绿色转化为黄色,故B错误;
C.CO2和偏铝酸钠反应生成氢氧化铝沉淀,发生反应AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,所以有白色沉淀生成,故C错误;
D.酸性条件下NO3-与SO2发生氧化还原反应生成SO42-,生成的沉淀为BaSO4,所以有明显现象,故D错误;
故选A.
B.NO2和水反应生成硝酸,硝酸能将亚铁离子氧化为铁离子,所以溶液由浅绿色转化为黄色,故B错误;
C.CO2和偏铝酸钠反应生成氢氧化铝沉淀,发生反应AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,所以有白色沉淀生成,故C错误;
D.酸性条件下NO3-与SO2发生氧化还原反应生成SO42-,生成的沉淀为BaSO4,所以有明显现象,故D错误;
故选A.
点评:本题考查物质之间的反应,明确物质的性质是解本题关键,注意C中发生的反应,易错选项是D,注意硝酸根离子和二氧化硫反应产物,题目难度不大.

练习册系列答案
相关题目
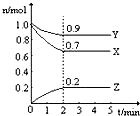 某温度时,2L容器中三种物质的物质的量随时间的变化曲线如图所示.由图中数据分析,该反应的化学方程式和反应开始至2min末Z的平均速率分别为( )
某温度时,2L容器中三种物质的物质的量随时间的变化曲线如图所示.由图中数据分析,该反应的化学方程式和反应开始至2min末Z的平均速率分别为( )| A、3X+Y?2Z; 0.05 mol/(L?min) |
| B、2X+Y?2Z; 0.1 mol/(L?min) |
| C、3X+Y?2Z; 0.1 mol/(L?min) |
| D、X+3Y?2Z; 0.05 mol/(L?min) |
除去镁粉中的少量铝粉,可选用( )
| A、硫酸 | B、水 |
| C、盐酸 | D、氢氧化钠溶液 |
我国报道的高温超导体中,铊是组成成分之一.已知铊和铝是同族元素,关于铊的判断错误的是( )
| A、铊是银白色的金属 |
| B、氢氧化铊是两性氢氧化物 |
| C、能生成+3价的化合物 |
| D、能置换出盐酸中的氢 |
某同学在实验室用17.4g MnO2和50mL 8mol/L浓盐酸加热制Cl2,在常温常压下,该同学可制得Cl2( )
| A、2.24L | B、0.2mol |
| C、7.1g | D、无法计算 |

 ;
; ;
; ;
; .
.