题目内容
8.下列对有关铁和铝反应现象的描述,正确的是( )| A. | 在氯气中点燃细铁丝产生白色的烟 | |
| B. | 铁粉和硫粉混合加热生成黑色固体 | |
| C. | 纯铝在空气中放置会长出白毛 | |
| D. | 将铝片放入CuSO4溶液反应完全后,溶液由蓝色变为红色 |
分析 A.铁丝在氯气中燃烧生成红棕色烟;
B.Fe与S反应生成FeS;
C.Al易被氧化生成氧化铝;
D.铝片放入CuSO4溶液中反应生成硫酸铝和Cu.
解答 解:A.铁丝在氯气中燃烧生成氯化铁,观察到红棕色烟,故A错误;
B.Fe与S反应生成FeS,则观察到生成黑色固体,故B正确;
C.Al易被氧化生成氧化铝,为白色固体,则观察到纯铝在空气中放置会长出白毛,故C正确;
D.铝片放入CuSO4溶液中反应生成硫酸铝和Cu,则溶液由蓝色变为无色,故D错误;
故选BC.
点评 本题考查常见金属单质的性质,为高频考点,把握发生的反应及现象为解答的关键,侧重实验现象与反应原理的考查,题目难度不大.

练习册系列答案
相关题目
18.下列溶液中各微粒的浓度关系不正确的是( )
| A. | 0.1mol•L-1 CH3COOH溶液中:c(CH3COO-)+c(OH-)=c(H+) | |
| B. | 1 L0.l mol•L-1CuSO4•(NH4)2SO4•6H2O的溶液中:c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-) | |
| C. | 0.1mol•L-1NaHCO3溶液中:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) | |
| D. | 等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(X-)>c(H+)>(OH-) |
16.含碘食盐中的碘是以碘酸钾(KIO3)形式存在的.已知在酸性溶液中IO3-和I-发生下列反应IO3-+5I-+6H+=3I2+3H2O.现有下列物质 ①稀硫酸;②pH试纸;③淀粉碘化钾溶液;④淀粉溶液.利用上述反应,可用来检验含碘食盐中含有IO3-的是( )
| A. | ①③ | B. | ②③ | C. | ①④ | D. | ②④ |
3.室温下向10mL氨水溶液中加水稀释后,下列各量增大的有( )(下同),减小的有( )
| A. | 溶液中c(NH4+)离子浓度 | B. | 氨水的电离程度 | ||
| C. | 水的离子积常数 | D. | c(H+)/c(NH3•H2O) |
20.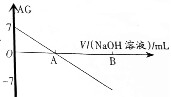 若用AG表示溶液的酸度(acidity grade),AG的定义为AG=lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$].室温下实验室中用0.01mol•L-1的氢氧化钠溶液滴定20.00mL0.01mol•L-1的醋酸,滴定过程如图所示,下列叙述正确的是( )
若用AG表示溶液的酸度(acidity grade),AG的定义为AG=lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$].室温下实验室中用0.01mol•L-1的氢氧化钠溶液滴定20.00mL0.01mol•L-1的醋酸,滴定过程如图所示,下列叙述正确的是( )
 若用AG表示溶液的酸度(acidity grade),AG的定义为AG=lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$].室温下实验室中用0.01mol•L-1的氢氧化钠溶液滴定20.00mL0.01mol•L-1的醋酸,滴定过程如图所示,下列叙述正确的是( )
若用AG表示溶液的酸度(acidity grade),AG的定义为AG=lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$].室温下实验室中用0.01mol•L-1的氢氧化钠溶液滴定20.00mL0.01mol•L-1的醋酸,滴定过程如图所示,下列叙述正确的是( )| A. | 室温下,醋酸的电离常数约为10-6 | |
| B. | A点时加入氢氧化钠溶液的体积为20.00mL | |
| C. | 若B点为40mL,所得溶液中:c(OH-)=c(CH3COO-)+c(H+)+2c(CH3COOH) | |
| D. | 反应过程中一定存在:0.01mol•L-1+c(OH-)=c(Na+)+c(H+)+c(CH3COOH) |
7.某温度下,可逆反应mA(g)+nB(g)??pC(g)的平衡常数为K,下列对K的说法正确的是( )
| A. | K值越大,表明该反应越有利于C的生成 | |
| B. | 若缩小反应器的容积,能使平衡正向移动,则K增大 | |
| C. | 温度越高,K一定越大 | |
| D. | 如果m+n=p,则K=1 |