题目内容
雷尼镍(RAney-Ni)是一种历史悠久、应用广泛的催化剂,由镍-铝合金为原料制得.
(1)元素第一电离能:Al Mg(选填:“>”、“<”、“=”)
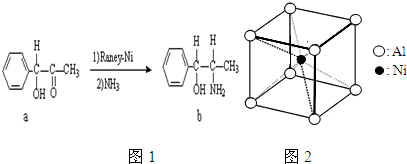
(2)雷尼镍催化的一实例为图1:化合物b中除苯环外的C原子、O原子、N原子进行的杂化的方式分别是: , , ;
(3)一种铝镍合金的晶胞结构如图2,该合金的化学式为 ,与其结构相似的化合物是 (填编号)A.氯化钠 B.金刚石 C.石英 D.氯化铯,其中Al原子的配位数为 ;
(4)基态Ni原子的简化电子排布式为 .
(1)元素第一电离能:Al
(2)雷尼镍催化的一实例为图1:化合物b中除苯环外的C原子、O原子、N原子进行的杂化的方式分别是:
(3)一种铝镍合金的晶胞结构如图2,该合金的化学式为
(4)基态Ni原子的简化电子排布式为

考点:元素电离能、电负性的含义及应用,原子核外电子排布,原子轨道杂化方式及杂化类型判断
专题:
分析:(1)Mg元素原子的3s能级容纳2个电子,为全满稳定状态,能量降低;
(2)侧链中C、O、N原子根据成的单键数目与孤对电子确定杂化轨道数目判断杂化方式;
(3)由图可知铝镍合金的晶胞结构中,Ni原子数目为1,Al原子数目为8×
=1,为AlNi,每个Ni原子周围有8个Al原子,每个Al原子周围有8个Ni原子,据此结合选项中各物质的晶胞结构判断;
(4)根据核外电子排布规律书写.
(2)侧链中C、O、N原子根据成的单键数目与孤对电子确定杂化轨道数目判断杂化方式;
(3)由图可知铝镍合金的晶胞结构中,Ni原子数目为1,Al原子数目为8×
| 1 |
| 8 |
(4)根据核外电子排布规律书写.
解答:
解:(1)Mg元素原子的3s能级容纳2个电子,为全满稳定状态,能量降低,第一电离能高于同周期相邻的元素,故第一电离能Al<Mg,故答案为:<;
(2)苯环中存在大π键,碳原子杂化数为2,采取sp2杂化,侧链中C原子成4个单键,杂化轨道数为4,采取sp3杂化,O原子成2个单键,含有2对孤对电子,杂化轨道数为4,采取sp3杂化,N原子成3个单键,含有1对孤对电子,杂化轨道数为4,采取sp3杂化,
故答案为:sp3、sp3、sp3;
(3)由图可知铝镍合金的晶胞结构中,Ni原子数目为1,Al原子数目为8×
=1,为AlNi,每个Ni原子周围有8个Al原子,每个Al原子周围有8个Ni原子,
A.氯化钠中每个钠离子周围有6个氯离子,每个氯离子周围有6个钠离子,不符合;
B.金刚石为空间立体网状结构,每C原子周围有4个C原子,不符合;
C.石英为空间立体网状结构,硅原子周围有4个氧原子,氧原子周围有2个硅原子,不符合;
D.氯化铯中每个铯离子周围有8个氯离子,每个氯离子周围有8个铯离子,符合;故答案为:AlNi;D;8;
(4)Ni是28号元素,核外有28个电子,其原子核外电子排布为[Ar]3d84s2,
故答案为:[Ar]3d84s2.
(2)苯环中存在大π键,碳原子杂化数为2,采取sp2杂化,侧链中C原子成4个单键,杂化轨道数为4,采取sp3杂化,O原子成2个单键,含有2对孤对电子,杂化轨道数为4,采取sp3杂化,N原子成3个单键,含有1对孤对电子,杂化轨道数为4,采取sp3杂化,
故答案为:sp3、sp3、sp3;
(3)由图可知铝镍合金的晶胞结构中,Ni原子数目为1,Al原子数目为8×
| 1 |
| 8 |
A.氯化钠中每个钠离子周围有6个氯离子,每个氯离子周围有6个钠离子,不符合;
B.金刚石为空间立体网状结构,每C原子周围有4个C原子,不符合;
C.石英为空间立体网状结构,硅原子周围有4个氧原子,氧原子周围有2个硅原子,不符合;
D.氯化铯中每个铯离子周围有8个氯离子,每个氯离子周围有8个铯离子,符合;故答案为:AlNi;D;8;
(4)Ni是28号元素,核外有28个电子,其原子核外电子排布为[Ar]3d84s2,
故答案为:[Ar]3d84s2.
点评:本题考查知识点有电离能、杂化轨道、化学键、核外电子排布规律等,涉及的知识点较多,题目综合性较强,难度中等.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
反应A(g)+3B(g)═2C(g)+2D(g),在不同情况下测得的反应速率如下,其中反应速率最大的是( )
| A、v(D)=0.4 mol?L-1?s-1 |
| B、v(C)=0.5 mol?L-1?s-1 |
| C、v(B)=0.6 mol?L-1?s-1 |
| D、v(A)=0.15 mol?L-1?s-1 |
通过复习总结,下列归纳正确的是( )
| A、Na2O,NaOH,Na2CO3,NaCl,Na2SO4,Na2O2都属于钠的含氧化合物 |
| B、简单非金属阴离子只有还原性,而金属阳离子不一定只有氧化性 |
| C、一种元素可能有多种氧化物,但同种化合价只对应有一种氧化物 |
| D、物质发生化学变化一定有化学键断裂与生成,并伴有能量变化,而发生物理变化就一定没有化学键断裂或生成 |
以下微粒含配位键的是( )
①N2H5+ ②CH4 ③OH-④NH4+⑤NH3⑥Fe(SCN)3⑦H3O+⑧[Cu(NH3)4]2+.
①N2H5+ ②CH4 ③OH-④NH4+⑤NH3⑥Fe(SCN)3⑦H3O+⑧[Cu(NH3)4]2+.
| A、①④⑥⑦⑧ | B、①②④⑦⑧ |
| C、③④⑤⑥⑦ | D、全部 |
在给定条件的水溶液中一定能大量共存的离子组是( )
| A、无色溶液中:K+、Cu2+、Na+、MnO4-、SO42- |
| B、水电离产生的c(H+)=1×10-12mol?L-1的溶液中:Mg2+、SO42-、NO3-、Cl- |
| C、加入Al能放出H2的溶液中:Mg2+、Na+、NO3-、Cl- |
| D、能使pH试纸变为蓝色的溶液中:S2-、Na+、SO32-、Cl- |




