题目内容
16.托盘天平两盘内分别放入一个质量相同的烧杯,烧杯内盛有相同的硫酸100ml,浓度为1mol/L,现向两个烧杯中同时分别加入下列哪组物质,反应完毕后,天平仍保持平衡( )| A. | 6.5克镁、0.1mol锌 | B. | 1克镁、1克锌 | ||
| C. | 0.1克镁、0.1mol锌 | D. | 10克镁、13克锌 |
分析 硫酸的物质的量为:0.1L×1mol/L=0.1mol,选项中金属与硫酸反应生成+2价金属硫酸盐和氢气,金属质量与析出氢气的质量差相同时,天平平衡,以此来解答.
解答 解:硫酸的物质的量为:0.1L×1mol/L=0.1mol,Zn、Mg都是+2价计算,则硫酸完全反应消耗Mg、Zn的物质的量都是0.1mol,质量分别为2.4g、6.5g,
A.6.5克镁、0.1mol锌,6.5gMg的物质的量为:$\frac{6.5g}{24g/mol}$≈0.27>0.1mol,0.1mol锌恰好反应,且0.1molZn的质量为:65g/mol×0.1mol=6.5g,加入金属的质量相同,且放出氢气的质量也相同,则反应后天平仍然平衡,故A正确;
B.1克镁、1克锌,金属均不足,加入金属质量相同,生成氢气分别为$\frac{1}{12}$g、$\frac{2}{65}$g,则质量差不同,天平不会平衡,故B错误;
C.0.1克镁、0.1mol锌,锌的质量为6.5g,加入Zn的烧杯中质量增加为:6.5g-0.2g=6.3g>1g,显然两边质量增加不同,天平不会平衡,故C错误;
D.10克镁、13克锌,金属均过量,生成氢气相同,但加入金属的质量不同,则质量差不同,天平不平衡,故D错误;
故选A.
点评 本题考查化学反应的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,把握过量计算及天平平衡的问题为解答的关键,题目难度不大.

练习册系列答案
 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案
相关题目
6.有A、B、C、D四种金属.将A与B用导线连接起来侵入电解质溶液中,B为正极;将B、C分别投入等浓度盐酸中,B比C要反应剧烈.将C、D组成原电池,电子从C流向D.据此判断它们的活动性由弱到强的顺序是( )
| A. | A B D C | B. | B A C D | ||
| C. | A B C D | D. | B A D C |
7.用铁片与稀硫酸反应制取氢气时,下列措施能使氢气生成速率加大的是( )
| A. | 加少量CH3COONa固体 | B. | 加水 | ||
| C. | 不用稀硫酸,改用98%浓硫酸 | D. | 用含有杂质铜的铁片 |
4.下列说法不正确的是( )
| A. | 金属的冶炼原理,就是运用氧化还原反应原理,在一定条件下将金属从其化合物中还原出来 | |
| B. | 有些活泼金属如铝可作热还原法的还原剂 | |
| C. | 用电解熔融NaCl的方法来冶炼金属钠 | |
| D. | 用焦炭或一氧化碳还原氧化铝的方法来冶炼铝 |
11.下列离子方程式书写正确的是( )
| A. | 铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| B. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | 氢氧化钡溶液与盐酸反应:OH-+H+═H2O | |
| D. | 硫酸铜溶液与氢氧化钡溶液混合:Cu2++2 OH-═Cu(OH)2↓ |
1. 现使用酸碱中和滴定法测定市售白醋的浓度.
现使用酸碱中和滴定法测定市售白醋的浓度.
Ⅰ.实验步骤:
(1)取10.00mL市售白醋放入烧杯(填仪器名称,下同)中,用水稀释后转移到100mL容量瓶中,洗涤、转移、定容、摇匀即得待测白醋溶液.
(2)取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴酚酞作指示剂.
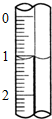
(3)读取盛装0.1000mol/L NaOH 溶液的滴定管的初始读数.如果液面位置如右图所示,则此时的读数为1.10mL.
(4)滴定时一手控制活塞,一手握住锥形瓶颈轻轻摇动,双眼注视锥形瓶中溶液的颜色变化.当溶液由无色恰好变为浅红色,并在半分钟内不褪色时,
停止滴定,并记录NaOH溶液的终读数.重复滴定3次.
Ⅱ.实验记录:
Ⅲ.数据处理与讨论:
(5)甲同学在处理数据时计算得:
平均消耗的NaOH溶液的体积V=$\frac{(14.95+16.05+15.95)}{3}$=15.65(mL)
乙同学认为处理数据时第一次实验的数据应该舍去,原因是第1次数据误差明显过大,属异常值,应舍去.
按正确数据处理,可得c(市售白醋)=0.80mol/L.
(6)在本实验的滴定过程中,下列操作会使实验结果偏大的是ab(填写序号).
a.滴定管在滴定时未用标准NaOH溶液润洗
b.滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出.
 现使用酸碱中和滴定法测定市售白醋的浓度.
现使用酸碱中和滴定法测定市售白醋的浓度.Ⅰ.实验步骤:
(1)取10.00mL市售白醋放入烧杯(填仪器名称,下同)中,用水稀释后转移到100mL容量瓶中,洗涤、转移、定容、摇匀即得待测白醋溶液.
(2)取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴酚酞作指示剂.
(3)读取盛装0.1000mol/L NaOH 溶液的滴定管的初始读数.如果液面位置如右图所示,则此时的读数为1.10mL.
(4)滴定时一手控制活塞,一手握住锥形瓶颈轻轻摇动,双眼注视锥形瓶中溶液的颜色变化.当溶液由无色恰好变为浅红色,并在半分钟内不褪色时,
停止滴定,并记录NaOH溶液的终读数.重复滴定3次.
Ⅱ.实验记录:
次数 数据(mL) | 1 | 2 | 3 |
| V(样品) | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 14.95 | 16.05 | 15.95 |
(5)甲同学在处理数据时计算得:
平均消耗的NaOH溶液的体积V=$\frac{(14.95+16.05+15.95)}{3}$=15.65(mL)
乙同学认为处理数据时第一次实验的数据应该舍去,原因是第1次数据误差明显过大,属异常值,应舍去.
按正确数据处理,可得c(市售白醋)=0.80mol/L.
(6)在本实验的滴定过程中,下列操作会使实验结果偏大的是ab(填写序号).
a.滴定管在滴定时未用标准NaOH溶液润洗
b.滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出.
5.在下列实验过程中,产生的现象与图中对应的图形不相符的是( )
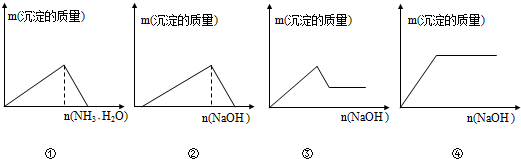

| A. | ①在AlCl3溶液中滴加氨水至过量 | |
| B. | ②在盐酸酸化过的AlCl3溶液中滴加氢氧化钠溶液至过量 | |
| C. | ③在AlCl3和FeCl3混合液中滴加氢氧化钠溶液至过量 | |
| D. | ④在FeCl3溶液中滴加氢氧化钠溶液至过量 |

 .
. +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaBr+2H2O.
+2NaBr+2H2O.