题目内容
 下图中的实验装置可以用于实验室制取乙炔.请填空:
下图中的实验装置可以用于实验室制取乙炔.请填空:(1)图中A管的作用是
(2)乙炔通入酸性KMnO4溶液中,发生
(3)乙炔燃烧时的现象为
考点:乙炔炔烃
专题:有机物的化学性质及推断
分析:(1)通过A管的移动可以控制反应的发生和停止;碳化钙与水反应生成氢氧化钙和乙炔;
(2)乙炔含碳碳三键,具有还原性,能被酸性的高锰酸钾氧化,能与溴发生加成反应;
(3)乙炔含碳量高,燃烧时火焰明亮,伴有浓黑烟;可燃气体在燃烧之前一定先验纯.
(2)乙炔含碳碳三键,具有还原性,能被酸性的高锰酸钾氧化,能与溴发生加成反应;
(3)乙炔含碳量高,燃烧时火焰明亮,伴有浓黑烟;可燃气体在燃烧之前一定先验纯.
解答:
解:(1)图示装置可通过调节A管的高度,控制反应的发生和停止:将A管提高,右管中水面上升,与电石接触发生反应;将A管降低,右管中水面下降,水与电石脱离接触,反应停止,则制取乙炔的化学反应方程式为CaC2+2H2O→Ca(OH)2+CH≡CH↑;
故答案为:调节水面的高度来控制反应的发生和停止;CaC2+2H2O→Ca(OH)2+CH≡CH↑;
(2)乙炔含碳碳三键,具有还原性,能被酸性的高锰酸钾氧化,酸性的高锰酸钾被还原,溶液褪色;乙炔含碳碳三键,若通入溴水中,与溴发生加成反应,使溴水褪色;
故答案为:氧化;紫色的高锰酸钾褪色;加成;
(3)乙炔中含碳的质量分数较大,燃烧时火焰明亮并伴有浓烈的黑烟;乙炔点燃前必须检验其纯度;
故答案为:火焰明亮并伴有浓烈的黑烟;乙炔点燃前必须检验其纯度.
故答案为:调节水面的高度来控制反应的发生和停止;CaC2+2H2O→Ca(OH)2+CH≡CH↑;
(2)乙炔含碳碳三键,具有还原性,能被酸性的高锰酸钾氧化,酸性的高锰酸钾被还原,溶液褪色;乙炔含碳碳三键,若通入溴水中,与溴发生加成反应,使溴水褪色;
故答案为:氧化;紫色的高锰酸钾褪色;加成;
(3)乙炔中含碳的质量分数较大,燃烧时火焰明亮并伴有浓烈的黑烟;乙炔点燃前必须检验其纯度;
故答案为:火焰明亮并伴有浓烈的黑烟;乙炔点燃前必须检验其纯度.
点评:本题考查乙炔的实验室制法及其性质,侧重基础知识的考查,熟悉乙炔的结构和性质即可解答,难度中等.

练习册系列答案
相关题目
下列有关叙述正确的是( )
| A、元素性质呈周期性变化的根本原因是元素化合价呈周期性变化 |
| B、BF3和CO2分子中所有原子均满足最外层为8电子结构 |
| C、已知114号元素的一种核素的质量数为298,则该元素的相对原子质量为298 |
| D、[14NH3T]+ 中,电子数、质子数、中子数之比为10:11:9 |
一定条件下发生化学反应:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol.现有容积均为1L的甲、乙、丙、丁四个容器,在上述条件下分别充入气体,到达平衡时,反应放出的热量(Q),及平衡时的转化率(X)如下表所示:
下列叙述正确的是( )
| 容器 | 起始时各物质的量(mol) | 到达平衡时放出 的热量(QkJ) |
平衡时SO2转化率(X) | |||
| SO2 | O2 | SO3 | N2 | |||
| 甲 | 2 | 1 | 0 | 0 | Q1 | X1 |
| 乙 | 1 | 0.5 | 0 | 0 | Q2=39.4 | X2 |
| 丙 | 1 | 0.5 | 0 | 1 | Q3 | X3 |
| 丁 | 1.8 | 0.9 | 0.2 | 0 | Q4 | X4 |
| A、Q1=78.8 |
| B、Q1=Q4>Q2=Q3 |
| C、X1>X3=40% |
| D、X1=X4>X2=X3 |
 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验. )的分子式为
)的分子式为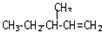 一定条件发生加聚反应时的化学方程式
一定条件发生加聚反应时的化学方程式
 合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下: