题目内容
7.下列有关反应2NO+2CO $\frac{\underline{\;催化剂\;}}{△}$ N2+2CO2的叙述中,正确的是( )| A. | 该反应是复分解反应 | B. | NO发生还原反应 | ||
| C. | CO是氧化剂 | D. | 反应物中O得电子 |
分析 2NO+2CO$\frac{\underline{催化剂}}{△}$N2+CO2中,N元素的化合价降低,C元素的化合价升高,结合四种基本反应类型来解答.
解答 解:A.该反应中存在化合价的变化,是氧化还原反应,不是复分解反应,故A错误;
B.N元素的化合价降低,则NO得电子发生还原反应,故B正确;
C.C元素的化合价升高,则CO为还原剂,故C错误;
D.N元素的化合价降低,NO中N元素得到电子,故D错误;
故选B.
点评 本题考查氧化还原反应,把握反应中的元素化合价变化为解答的关键,侧重反应类型的判断及基本概念的考查,题目难度不大.

练习册系列答案
相关题目
12.下列说法正确的是( )
| A. | 碘升华时需要克服分子间作用力,不破坏共价键 | |
| B. | NaCl和HCl溶于水都电离出Cl-,故它们都存在离子键 | |
| C. | 干冰和水分子中,每个原子的最外层都具有8电子稳定结构 | |
| D. | 离子化合物在任何状态下都能导电 |
19.三氧化二铁和氧化亚铜都是红色粉末,常用作颜料.某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物.探究过程如下:
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,Cu2O在空气中加热生成CuO
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂.
(1)若假设1成立,则实验现象是固体完全溶解,溶液呈血红色.
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?不合理;当原固体粉末为Fe2O3和Cu2O的混合物时,加入稀H2SO4后产生的Fe3+与Cu反应生成Fe2+,滴加KSCN溶液后也可能不变红色.
(3)若固体粉末完全溶解无固体存在,滴加 KSCN 试剂时溶液不变红色,则证明原固体粉末是Fe2O3和Cu2O,写出发生反应的离子方程式Cu2O+2H+═Cu+Cu2++H2O、2Fe3++Cu═2Fe2++Cu2+.
探究延伸
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物.
(4)实验小组欲用加热法测定Cu2O的质量分数.取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为$\frac{9(b-a)}{a}$×100%.
(5)欲利用红色粉末Fe2O3和Cu2O的混合物制取较纯净的胆矾 (CuSO4•5H2O)经查阅资料得知,在溶液中调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH
实验室有下列试剂可供选择:
A.氯水 B.H2O2 C.硝酸 D.NaOH E.氨水 F.Cu2(OH)2CO3
实验小组设计如下实验方案:
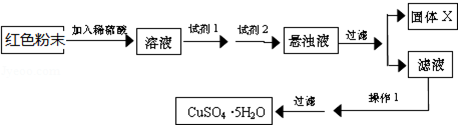
试回答:①试剂I为B,试剂II为F(填字母).
②固体X的化学式为Fe(OH)3.
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,Cu2O在空气中加热生成CuO
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂.
(1)若假设1成立,则实验现象是固体完全溶解,溶液呈血红色.
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?不合理;当原固体粉末为Fe2O3和Cu2O的混合物时,加入稀H2SO4后产生的Fe3+与Cu反应生成Fe2+,滴加KSCN溶液后也可能不变红色.
(3)若固体粉末完全溶解无固体存在,滴加 KSCN 试剂时溶液不变红色,则证明原固体粉末是Fe2O3和Cu2O,写出发生反应的离子方程式Cu2O+2H+═Cu+Cu2++H2O、2Fe3++Cu═2Fe2++Cu2+.
探究延伸
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物.
(4)实验小组欲用加热法测定Cu2O的质量分数.取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为$\frac{9(b-a)}{a}$×100%.
(5)欲利用红色粉末Fe2O3和Cu2O的混合物制取较纯净的胆矾 (CuSO4•5H2O)经查阅资料得知,在溶液中调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
A.氯水 B.H2O2 C.硝酸 D.NaOH E.氨水 F.Cu2(OH)2CO3
实验小组设计如下实验方案:

试回答:①试剂I为B,试剂II为F(填字母).
②固体X的化学式为Fe(OH)3.
17.改变某一条件使NH4Cl稀溶液中NH4+的数目增加,下列说法正确的是( )
| A. | 此时溶液可能为中性 | |
| B. | 此时溶液中NH4+的浓度一定增大 | |
| C. | 此时NH4+的水解程度一定增大 | |
| D. | 此过程中,溶液中NH3•H2O和NH4+的数目之和一定增大 |
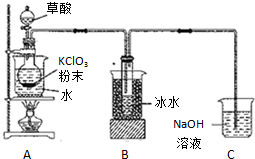 二氧化氯(ClO2)是一种高效消毒剂,沸点为11℃.用KClO3粉末与草酸(H2C2O4)在60℃时反应可生成ClO2等物质,实验装置如图所示:
二氧化氯(ClO2)是一种高效消毒剂,沸点为11℃.用KClO3粉末与草酸(H2C2O4)在60℃时反应可生成ClO2等物质,实验装置如图所示: