题目内容
200℃时,CO2和水蒸气的混合气体共23.2g与足量的Na2O2充分反应后,固体质量增加了7.2g,则原混合气体的平均相对分子质量为( )
| A、5.8 | B、11.6 | C、23.2 | D、46.4 |
分析:向足量的固体Na2O2中通入23.2gCO2和H2O,发生反应:2Na2O2+2CO2=Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,固体只增加了7.2g,是因为生成O2,根据质量守恒定律可知m(O2)=23.2gg-7.2g=16g,根据n=
计算生成氧气的物质的量,根据方程式可知n(混合气体)=2n(O2),进而计算原混合气体的平均相对分子质量.
| m |
| M |
解答:解:向足量的固体Na2O2中通入23.2gCO2和H2O,发生反应:2Na2O2+2CO2=Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,固体只增加了7.2g,是因为生成O2,根据质量守恒定律可知m(O2)=23.2gg-7.2g=16g,所以n(O2)=
=0.5mol,
根据方程式可知n(混合气体)=2n(O2)=2×0.5mol=1mol,故混合气体的平均摩尔质量=
=23.2g/mol,故混合气体的平均相对分子质量为23.2,
故选C.
| 16g |
| 32g/mol |
根据方程式可知n(混合气体)=2n(O2)=2×0.5mol=1mol,故混合气体的平均摩尔质量=
| 23.2g |
| 1mol |
故选C.
点评:本题考查混合物的有关计算、过氧化钠的性质等,注意理解固体质量变化的原因,根据反应的方程式计算,难度中等.

练习册系列答案
相关题目
 200℃时,11.6gCO2和水蒸气的混合气体与足量的Na2O2充分反应后固体质量增加了3.6g(如图所示),其原混合物中CO2和H2O的物质的量比.
200℃时,11.6gCO2和水蒸气的混合气体与足量的Na2O2充分反应后固体质量增加了3.6g(如图所示),其原混合物中CO2和H2O的物质的量比.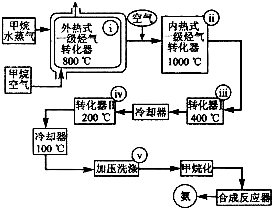 某工厂以天然气、水蒸气和空气为原料和能源合成氨的流程如图.该流程中外热式一级烃转化器系指以CH4为燃料在烃气转化器外面加热使之维持800℃高温的工业装置.内热式一级烃气转 化器系指以H2在装置内燃烧为能量维护一 级烃气转化器所生成的CO与H20(g)反应 生成C02和H2所需1000℃高温的装置.
某工厂以天然气、水蒸气和空气为原料和能源合成氨的流程如图.该流程中外热式一级烃转化器系指以CH4为燃料在烃气转化器外面加热使之维持800℃高温的工业装置.内热式一级烃气转 化器系指以H2在装置内燃烧为能量维护一 级烃气转化器所生成的CO与H20(g)反应 生成C02和H2所需1000℃高温的装置.