题目内容
 合成氨工业对国民经济和社会发展具有重要的意义.其原理为:
合成氨工业对国民经济和社会发展具有重要的意义.其原理为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
据此回答:
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,说明
(2)一定条件下合成氨反应的平衡常数表达式为K=
温度升高,合成氨反应的K将
(3)若合成氨反应达到平衡时,c(N2)=3mol/L,c(H2)=9mol/L,c(NH3)=4mol/L.则起始时c(N2)=
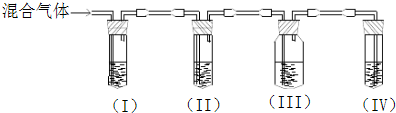
(4)1998 年两位希腊化学家 George Marnellos 和 Michael Stoukides 发明一种合成氨新方法.在常压下,将 H2 与用 He 稀释的 N2 分别通入一加热到 570℃的以锶-铈-钇-钙钛矿多孔陶瓷 (SCY) 为固体电解质的电解池中,用覆盖在固体电解质内外表面的多孔钯多晶薄膜催化,转化为氨,H2转化率达到 78%.实验装置如图所示.通电后,H2发生的电极反应式为:H2-2e-=2H+,则图中电源a为
考点:化学平衡常数的含义,原电池和电解池的工作原理,化学平衡的计算
专题:化学平衡专题,电化学专题
分析:(1)平衡常数是衡量化学平衡进行程度的物理量,依据表达式分析判断平衡常数越大,正反应进行程度越大,平衡常数随温度变化不随浓度变化;
(2)依据化学方程式书写平衡常数表达式,用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,反应是放热反应升温平衡逆向进行;
(3)依据化学平衡三段式列式计算,起始量=消耗量+平衡量,转化率=
计算;
(4)依据图示装置,电解池阳极发生氧化反应,阴极发生还原反应,据此判断并写出电极反应式.
(2)依据化学方程式书写平衡常数表达式,用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,反应是放热反应升温平衡逆向进行;
(3)依据化学平衡三段式列式计算,起始量=消耗量+平衡量,转化率=
| 消耗量 |
| 转化量 |
(4)依据图示装置,电解池阳极发生氧化反应,阴极发生还原反应,据此判断并写出电极反应式.
解答:
解:(1)化学平衡常数K表示可逆反应的进行程度,K值越大,依据计算表达式可知,正反应进行程度越大,平衡常数岁温度变化,不随浓度改变,平衡常数不变;
故答案为:正;不变;
(2)N2(g)+3H2(g)?2NH3(g),依据平衡常数概念K=
,反应是放热反应,升温平衡逆向进行,平衡常数减小;
故答案为:
;减小;
(3)若合成氨反应达到平衡时,c(N2)=3mol/L,c(H2)=9mol/L,c(NH3)=4mol/L,
N2(g)+3H2(g)?2NH3(g)
起始量(mol) 5 15 0
变化量(mol) 2 6 4
平衡量(mol) 3 9 4
起始时c(N2)=5mol/L,
平衡时H2的转化率=
×100%=40%
故答案为:5;40%;
(4)由图可知,氮气在(3)电极放电生成氨气,所以电极为阴极,与电源负极相连,a为负极,在电解池中,阴极发生得电子的还原反应,
氮气得电子的过程为:N2+6e-+6H+=2NH3,
故答案为:负,N2+6H++6e-=2NH3;
故答案为:正;不变;
(2)N2(g)+3H2(g)?2NH3(g),依据平衡常数概念K=
| c2(NH3) |
| c(N2)c3(H2) |
故答案为:
| c2(NH3) |
| c(N2)c3(H2) |
(3)若合成氨反应达到平衡时,c(N2)=3mol/L,c(H2)=9mol/L,c(NH3)=4mol/L,
N2(g)+3H2(g)?2NH3(g)
起始量(mol) 5 15 0
变化量(mol) 2 6 4
平衡量(mol) 3 9 4
起始时c(N2)=5mol/L,
平衡时H2的转化率=
| 6mol |
| 15mol |
故答案为:5;40%;
(4)由图可知,氮气在(3)电极放电生成氨气,所以电极为阴极,与电源负极相连,a为负极,在电解池中,阴极发生得电子的还原反应,
氮气得电子的过程为:N2+6e-+6H+=2NH3,
故答案为:负,N2+6H++6e-=2NH3;
点评:本题考查平衡常数概念和计算应用、平衡常数影响因素、反应物转化率、电解池原理的分析判断等,要求学生具有分析和解决问题的能力,难度中等.

练习册系列答案
相关题目
下列离子方程式的书写不正确的是( )
| A、铁跟稀硫酸反应:Fe+2H+=Fe2++H2↑ |
| B、Ca(HCO3)2溶液和盐酸反应:Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑ |
| C、醋酸跟氢氧化钾溶液反应:CH3COOH+OH-=CH3COO-+H2O |
| D、Na2CO3跟稀硫酸反应:CO32-+2H+=H2O+CO2↑ |
在水溶液中,因发生水解反应而不能大量共存的一组离子是( )
| A、CO32-、OH-、Na+、H+ |
| B、Al3+、Na+、AlO2-、Cl- |
| C、Ba2+、HCO3-、K+、SO42- |
| D、S2-、H+、SO42-、Cu2+ |
科学家对未发现的第114号元素很感兴趣,预测它有良好的力学、光学、电学性质,将它命名为“类铅”.以下对“类铅”的叙述不正确的是( )
| A、最外层有6个电子 |
| B、是金属 |
| C、主要化合价为+2,+4价 |
| D、最高价氧化物有较强氧化性 |