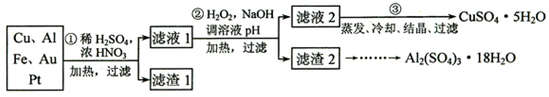
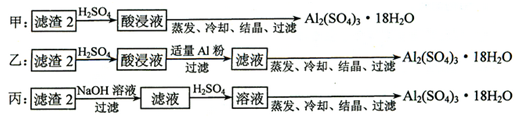
题目内容
10. X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示,若Z原子的最外层电子数是第一层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示,若Z原子的最外层电子数是第一层电子数的3倍,下列说法正确的是( )| A. | Z单质与氢气反应较Y剧烈 | |
| B. | 最高价氧化物对应水化物酸性W比Z强 | |
| C. | X单质氧化性强于Y单质 | |
| D. | X与W的原子核外电子数相差9 |
分析 X、Y、Z、W均为短周期元素,由元素相对位置可知,X和Y处于第二周期,Z和W处于第三周期,若Z原子的最外层电子数是第一层电子数的3倍,第一层电子为2,则Z元素最外层电子数是6,所以Z是S元素,可推知W为Cl元素,Y是O元素,X是N元素,结合元素周期律来分析解答.
解答 解:X、Y、Z、W均为短周期元素,由元素相对位置可知,X和Y处于第二周期,Z和W处于第三周期,若Z原子的最外层电子数是第一层电子数的3倍,第一层电子为2,则Z元素最外层电子数是6,所以Z是S元素,可推知W为Cl元素,Y是O元素,X是N元素.
A.非金属性Y(O)>Z(S),所以Y的单质与氢气反应较Z剧烈,故A错误;
B.非金属性W(Cl)>Z(S),所以最高价氧化物对应水化物的酸性W比Z强,故B正确;
C.X为N元素、Y为O元素,氧元素非金属性较强,故氮气的氧化性小于氧气,故C错误;
D.X为N元素、W为Cl元素,二者原子序数相差17-7=10,故D错误,
故选B.
点评 本题考查位置结构性质的应用,Z为解答本题的突破口,注意对元素周期律的理解掌握,题目难度不大.

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
17.已知下列物质的密度,计算1mol这些物质的体积,并将计算结果填入表中:
| 物质 | 摩尔质量g/mol-1 | 密度 | 1mol物质的体积 |
| Al | 26.98 | 2.70g•cm-3 | |
| Fe | 55.85 | 7.86g•cm-3 | |
| H2O | 18.02 | 0.998g•cm-3 | |
| C2H5OH | 46.07 | 0.789g•cm-3 | |
| H2 | 2.016 | 0.0899g•L-1 | |
| N2 | 28.02 | 1.25g•L-1 | |
| CO | 28.01 | 1.25g•L-1 |
5.以苯酚为原料合成对羟基苯乙酮的原理如图:

(1)乙酸苯酚酯制备:
将9.4g苯酚溶解在60mL10%的氢氧化钠溶液中,加入30g碎冰块,然后加入13.0g乙酸酐,搅拌5min.将反应后混合物倾入分液漏斗中,加入约4mL CCl4.将有机相用试剂X和水洗涤然后无水CaCl2干燥,蒸馏收集193-197℃馏分.
①用碎冰块代替水可能的原因是:该反应是放热反应,碎冰温度低有利于酯的生成.
②乙酸酐过量的目的是:提高苯酚的转化率.
③有机相先用试剂X洗涤,X可能是Na2CO3或NaHCO3溶液.
(2)对羟基苯乙酮的制备:
将乙酰苯酚6.8g,硝基苯20mL 放在三口烧瓶中,搅拌下加入无水AlCl3 11g(此时放热),加完后控制合适的温度,维持一定时间.然后冷却,倾入冰水中,用6mol/L HCl酸化分出硝基苯层,水层用氯仿萃取,蒸出氯仿得粗品.
①硝基苯的作用是作溶剂.
②乙酸苯酚重排为对羟基苯乙酮反应条件对收率的影响关系如表
适宜的温度是20~25;反应时间是180min.

(1)乙酸苯酚酯制备:
将9.4g苯酚溶解在60mL10%的氢氧化钠溶液中,加入30g碎冰块,然后加入13.0g乙酸酐,搅拌5min.将反应后混合物倾入分液漏斗中,加入约4mL CCl4.将有机相用试剂X和水洗涤然后无水CaCl2干燥,蒸馏收集193-197℃馏分.
①用碎冰块代替水可能的原因是:该反应是放热反应,碎冰温度低有利于酯的生成.
②乙酸酐过量的目的是:提高苯酚的转化率.
③有机相先用试剂X洗涤,X可能是Na2CO3或NaHCO3溶液.
(2)对羟基苯乙酮的制备:
将乙酰苯酚6.8g,硝基苯20mL 放在三口烧瓶中,搅拌下加入无水AlCl3 11g(此时放热),加完后控制合适的温度,维持一定时间.然后冷却,倾入冰水中,用6mol/L HCl酸化分出硝基苯层,水层用氯仿萃取,蒸出氯仿得粗品.
①硝基苯的作用是作溶剂.
②乙酸苯酚重排为对羟基苯乙酮反应条件对收率的影响关系如表
| 反应温度/℃ | 反应时间(min) | 收率 |
| 30~35 | 180 | 10.0 |
| 20~25 | 60 | 18.0 |
| 20~25 | 120 | 26.0 |
| 20~25 | 180 | 58.5 |
2.在一定条件下,对于密闭容器中的反应:N2+3H2?2NH3,下列说法正确的是( )
| A. | 增加N2的量,可以加快反应速率 | |
| B. | 当N2和H2全部转化为NH3时,反应才达到最大限度 | |
| C. | 达到平衡时,H2和NH3的浓度比一定为3:2 | |
| D. | 分别用N2和NH3来表示该反应的速率时,数值大小相同 |
19.W、X、Y、Z均为短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、8、8,它们的最外层电子数之和为18,下列说法正确的是( )
| A. | 氢化物稳定性:Y>Z | |
| B. | XW3与WZ相遇,产生大量白烟 | |
| C. | 氧化物的水化物的酸性:Y<Z | |
| D. | X与Z不能同时存在于同一离子化合物中 |
20.空气是人类生存所必需的重要资源.为改善空气质量而启动的“蓝天工程”得到了全民的支持.下列措施不属于“蓝天工程”建设的是( )
| A. | 推广使用燃煤脱硫技术,在燃煤中加入适量石灰石,可减少废气中的SO2 | |
| B. | 实施绿化工程,防治扬尘污染 | |
| C. | 研制开发燃料电池汽车,消除机动车尾气污染 | |
| D. | 加高工厂的烟囱,使烟尘和废气远离地表 |