题目内容
下列说法不正确的是( )
| A、有机物(CH3)2C=C(CH2CH3)2与H2发生加成后可得到含有手性碳原子的分子 |
| B、区分晶体和非晶体最可靠的科学方法是对固体进行X-射线衍射实验 |
| C、若aAm+与bBn-的核外电子排布相同,则b=a-n-m |
| D、离子化合物中可能含有共价键,共价化合物中一定不含离子键 |
考点:常见有机化合物的结构,质量数与质子数、中子数之间的相互关系,离子化合物的结构特征与性质,不同晶体的结构微粒及微粒间作用力的区别
专题:化学键与晶体结构,有机化学基础
分析:A.手性碳原子连接4个不同的原子或原子团,如果反应后的生成物的碳原子上连接4个不同的原子或原子团,则其生成物就含有手性碳原子;
B.构成晶体的粒子在微观空间里呈现周期性的有序排列;
C.aAm+与bBn-的核外电子排布相同,则有a-m=b+n;
D.含有离子键的化合物是离子化合物.
B.构成晶体的粒子在微观空间里呈现周期性的有序排列;
C.aAm+与bBn-的核外电子排布相同,则有a-m=b+n;
D.含有离子键的化合物是离子化合物.
解答:
解:A.(CH3)2C=C(CH2CH3)2与H2发生加成后生成(CH3)2CHCH(CH2CH3)2,(CH3)2CHCH(CH2CH3)2不是手性碳原子,故A错误;
B.构成晶体的粒子在微观空间里呈现周期性的有序排列,晶体的这一结构特征可以通过X-射线衍射图谱反映出来.因此,区分晶体和非晶体的最可靠的科学方法是对固体进行X-射线衍射实验,故B正确;
C.aAm+与bBn-的核外电子排布相同,则有a-m=b+n,即b=a-n-m,故C正确;
D.以共价键结合形成的化合物,叫做共价化合物.不同种非金属元素结合形成的化合物和大多数有机化合物,都属于共价化合物,所以共价化合物中一定没有离子键,故D正确.
故选A.
B.构成晶体的粒子在微观空间里呈现周期性的有序排列,晶体的这一结构特征可以通过X-射线衍射图谱反映出来.因此,区分晶体和非晶体的最可靠的科学方法是对固体进行X-射线衍射实验,故B正确;
C.aAm+与bBn-的核外电子排布相同,则有a-m=b+n,即b=a-n-m,故C正确;
D.以共价键结合形成的化合物,叫做共价化合物.不同种非金属元素结合形成的化合物和大多数有机化合物,都属于共价化合物,所以共价化合物中一定没有离子键,故D正确.
故选A.
点评:本题考查内容较多,涉及有机物的结构、晶体检验、原子结构与离子化合物等,难度不大,侧重对基础知识的巩固,注意对基础知识的理解掌握.

练习册系列答案
相关题目
下列物质中,既有离子键又有共价键的是( )
| A、Ca(NO3)2 |
| B、KOH |
| C、H2O |
| D、NH4F |
有关化学用语正确的是( )
A、-CH3(甲基)的电子式为  |
B、硝基苯的结构简式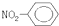 |
| C、乙烯的结构简式CH2CH2 |
| D、苯的分子式C6H6 |
设NA为阿伏加德罗常数的数值.对2mol CO2,下列说法中不正确 的是( )
| A、所含的C、O共6 mol |
| B、所含的C、O共6NA |
| C、所含的电子共22 mol |
| D、所含的电子共44NA |
 某有机物是药物生产的中间体,其结构简式为下列有关叙述正确的是( )
某有机物是药物生产的中间体,其结构简式为下列有关叙述正确的是( )| A、该有机物与Br2水发生加成反应 |
| B、该有机物与浓硫酸混合加热可发生消去反应 |
| C、该有机物经催化氧化后能发生银镜反应 |
| D、1 mol该有机物与足量NaOH溶液反应最多消耗3 mol NaOH |
下列说法正确的是( )
| A、将1 mol NaCl溶于1 L水中,所得溶液的物质的量浓度为1 mol/L |
| B、将2 mol KCl溶于适量水中,配成1L溶液,所得溶液的物质的量浓度为2 mol/L |
| C、将3 mol CuSO4溶于1000 g水中,所得溶液的物质的量浓度为3 mol/L |
| D、将4 mol NaOH溶于适量水中,配成1000 g 溶液,所得溶液的物质的量浓度为4 mol/L |