题目内容
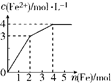 在Fe(NO3)3和Cu(NO3)2的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示.则该溶液中Fe(NO3)3与Cu(NO3)2的物质的量浓度之比为( )
在Fe(NO3)3和Cu(NO3)2的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示.则该溶液中Fe(NO3)3与Cu(NO3)2的物质的量浓度之比为( )| A、3:1 | B、1:2 |
| C、2:1 | D、1:1 |
考点:物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:根据氧化性:Fe3+>Cu2+,Fe先与氧化性强的物质反应,即先发生Fe+2Fe3+═3Fe2+,然后是Fe+Cu2+═Fe2++Cu,由图象可知,加入2molFe时,Fe与溶液中铁离子恰好完全反应,从2mol~4mol消耗的2molFe是与溶液中铜离子完全反应,据此计算.
解答:
解:根据氧化性:Fe3+>Cu2+,加入铁后会依次发生氧化还原反应,
①Fe+2Fe3+═3Fe2+;
②Fe+Cu2+═Cu+Fe2+;
从图象中可知加入2molFe时,发生反应①生成Fe2+物质的量为6mol,反应的Fe3+物质的量为4mol,即Fe(NO3)3为4mol;
在加入2molFe的基础上再加入2mol铁发生反应②,此时生成Fe2+物质的量为2mol,原溶液中Cu2+物质的量为2mol,即Cu(NO3)2为2mol;
所以原溶液中溶液中Fe(NO3)3、Cu(NO3)2的浓度之比为4mol:2mol=2:1,
故选:C.
①Fe+2Fe3+═3Fe2+;
②Fe+Cu2+═Cu+Fe2+;
从图象中可知加入2molFe时,发生反应①生成Fe2+物质的量为6mol,反应的Fe3+物质的量为4mol,即Fe(NO3)3为4mol;
在加入2molFe的基础上再加入2mol铁发生反应②,此时生成Fe2+物质的量为2mol,原溶液中Cu2+物质的量为2mol,即Cu(NO3)2为2mol;
所以原溶液中溶液中Fe(NO3)3、Cu(NO3)2的浓度之比为4mol:2mol=2:1,
故选:C.
点评:本题考查了铁及其化合物的性质应用,主要考查氧化还原反应的顺序反应规律及计算应用,明确图象中每段发生的化学反应是解答本题的关键,注意反应与图象的对应关系来解答,题目难度中等.

练习册系列答案
相关题目
下列各组离子一定能够大量共存的是( )
| A、使紫色石蕊变红的溶液:Fe2+、Mg2+、NO3-、Cl- |
| B、含有较多A13+的溶液:SO42-、Na+、Mg2+、NO3- |
| C、含有较多Fe3+的溶液:Na+、SO42-、SCN-、CO32- |
| D、无色透明的酸性溶液:MnO4-、K+、Cl-、HCO3- |
下列说法正确的是( )
A、1 mol β-紫罗兰酮 与1 mol H2发生加成反应可得到3 种不同产物 与1 mol H2发生加成反应可得到3 种不同产物 |
B、化合物 是苯的同系物 是苯的同系物 |
C、按系统命名法,有机物 可命名为3,7-二甲基-4-乙基辛烷 可命名为3,7-二甲基-4-乙基辛烷 |
D、目前市场上大量矿泉水、食用油等产品包装瓶几乎都是用PET( )的合成单体之一是对苯二甲酸 )的合成单体之一是对苯二甲酸 |
一定量的某有机物完全燃烧后,将燃烧产物通过足量的石灰水,经过滤可得沉淀10g,有机物燃烧产生2.7g水,则此有机物不可能是( )
| A、乙烷 | B、乙烯 | C、乙醇 | D、乙二醇 |
下列物质中含有共价键的离子化合物是( )
| A、Ba(OH)2 |
| B、CaCl2 |
| C、H2O |
| D、H2 |
 北京2008年奥运会的理念是“绿色奥运”“人文奥运”.举办“人文奥运”的一个重要体现是,禁止运动员服用兴奋剂.有一种兴奋剂的结构简式为,有关该物质的说法正确的是( )
北京2008年奥运会的理念是“绿色奥运”“人文奥运”.举办“人文奥运”的一个重要体现是,禁止运动员服用兴奋剂.有一种兴奋剂的结构简式为,有关该物质的说法正确的是( )| A、遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 |
| B、滴入KMnO4酸性溶液,观察到紫色褪去,可证明分子中存在双键 |
| C、1mol该物质与足量的碳酸氢钠反应,产生3mol CO2 |
| D、1mol该物质与浓溴水和H2反应时,最多消耗Br2和H2的物质的量分别为4 mol、7 mol |
 溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.某同学依据溴乙烷的性质,用如图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究.
溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.某同学依据溴乙烷的性质,用如图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究.


