题目内容
A、B、C、D四种物质均为下列离子组成的可溶性化合物,组成这四种物质的离子(离子不能重复组合)有:
分别取四种物质进行实验,实验结果如下
①B溶液分别与C、D混合,均有白色沉淀生成;
②将A溶液逐滴滴入C溶液中,有沉淀生成,继续滴加A溶液时,沉淀减少直至完全消失;
③A与D两种固体混合有气体生成,该气体能使湿润的红色石蕊试液变蓝;
④用石墨电极电解B溶液,在阳极上产生一种有刺激性气味的气体.回答下列问题:
(1)A所含的阴离子的电子式是 ,B所含的阳离子是 .
(2)C的化学式是 ,D的化学式是 .
(3)以Pt为电极电解1L0.1mol/LB的水溶液,当电路中通过0.1mol电子时,溶液的pH为 (设电解过程溶液体积不变),阳极的电极反应式为 .
(4)写出②中沉淀溶解的离子方程式 .
| 阳离子 | Na+、Al3+、Ba2+、NH4+ |
| 阴离子 | Cl-、OH-、CO32-、SO42- |
①B溶液分别与C、D混合,均有白色沉淀生成;
②将A溶液逐滴滴入C溶液中,有沉淀生成,继续滴加A溶液时,沉淀减少直至完全消失;
③A与D两种固体混合有气体生成,该气体能使湿润的红色石蕊试液变蓝;
④用石墨电极电解B溶液,在阳极上产生一种有刺激性气味的气体.回答下列问题:
(1)A所含的阴离子的电子式是
(2)C的化学式是
(3)以Pt为电极电解1L0.1mol/LB的水溶液,当电路中通过0.1mol电子时,溶液的pH为
(4)写出②中沉淀溶解的离子方程式
考点:物质的检验和鉴别的实验方案设计,原电池和电解池的工作原理
专题:离子反应专题,电化学专题
分析:②将A溶液逐滴滴入C溶液中,有沉淀生成,继续滴加A溶液时,沉淀减少直至完全消失,说明A为强碱溶液,则A为NaOH或氢氧化钡;C中含有Al3+;
③A与D两种固体混合有气体生成,该气体能使湿润的红色石蕊试液变蓝,气体为氨气,A或D中一定含有NH4+,由于A为强碱,则D中含有NH4+;
④用石墨电极电解B溶液,在阳极上产生一种有刺激性气味的气体,阴离子中能够产生刺激性气味的气体的为Cl-,则B中含有Cl-;
①B溶液分别与C、D混合,均有白色沉淀生成,B中含有Cl-,离子中不存在与氯离子生成沉淀的离子,所以只能是B中的阳离子生成沉淀,所以B为氯化钡;由于离子不能重复组合,则A只能为氢氧化钠;剩下的离子中,C中含有Al3+,则只能结合SO42-形成硫酸铝,最后D只能为碳酸铵,以此来解答.
③A与D两种固体混合有气体生成,该气体能使湿润的红色石蕊试液变蓝,气体为氨气,A或D中一定含有NH4+,由于A为强碱,则D中含有NH4+;
④用石墨电极电解B溶液,在阳极上产生一种有刺激性气味的气体,阴离子中能够产生刺激性气味的气体的为Cl-,则B中含有Cl-;
①B溶液分别与C、D混合,均有白色沉淀生成,B中含有Cl-,离子中不存在与氯离子生成沉淀的离子,所以只能是B中的阳离子生成沉淀,所以B为氯化钡;由于离子不能重复组合,则A只能为氢氧化钠;剩下的离子中,C中含有Al3+,则只能结合SO42-形成硫酸铝,最后D只能为碳酸铵,以此来解答.
解答:
解:由②可知A为强碱溶液,则A中含有OH-,A可能为NaOH或氢氧化钡,C中一定含有Al3+;
根据③能使湿润的红色石蕊试液变蓝的气体为氨气,则A或D中一定含有NH4+,由于A为强碱,则只能D中含有NH4+;
由④电解时阳极上产生一种有刺激性气味的气体,阴离子中能够产生刺激性气味的气体的只有Cl-,则B中含有Cl-;
再根据①B溶液分别与C、D混合均有白色沉淀生成,由于B中含有Cl-,Na+、Al3+、Ba2+、NH4+离子都不与氯离子生成沉淀,则B中含有能够生成沉淀的阳离子,所以B为氯化钡;由于离子不能重复组合,则A只能为氢氧化钠;剩下的离子中,C中含有Al3+,则只能结合SO42-形成硫酸铝,最后D只能为碳酸铵,
根据以上分析可知:A为NaOH,B为BaCl2,C为Al2(SO4)3,D为(NH4)2CO3,
(1)A为NaOH,阴离子为OH-,电子式为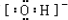 ,B中阳离子为Ba2+,故答案为:
,B中阳离子为Ba2+,故答案为: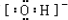 ;Ba2+;
;Ba2+;
(2)由上述分析可知,C为Al2(SO4)3,D为(NH4)2CO3,故答案为:Al2(SO4)3;(NH4)2CO3;
(3)以Pt为电极电解1L0.1mol/LB氯化钡的水溶液,反应生成氢气和氯气,当电路中通过0.1mol电子时,溶液中生成0.05mol氢气,同时生成0.1mol氢氧根离子,氢氧根离子浓度为0.1mol/L,溶液的pH为13;阳极氯离子失去电子发生氧化反应,电极反应式为:2Cl--2e-=Cl2,
故答案为:13; 2Cl--2e-=Cl2;
(4)②中沉淀溶解的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O.
根据③能使湿润的红色石蕊试液变蓝的气体为氨气,则A或D中一定含有NH4+,由于A为强碱,则只能D中含有NH4+;
由④电解时阳极上产生一种有刺激性气味的气体,阴离子中能够产生刺激性气味的气体的只有Cl-,则B中含有Cl-;
再根据①B溶液分别与C、D混合均有白色沉淀生成,由于B中含有Cl-,Na+、Al3+、Ba2+、NH4+离子都不与氯离子生成沉淀,则B中含有能够生成沉淀的阳离子,所以B为氯化钡;由于离子不能重复组合,则A只能为氢氧化钠;剩下的离子中,C中含有Al3+,则只能结合SO42-形成硫酸铝,最后D只能为碳酸铵,
根据以上分析可知:A为NaOH,B为BaCl2,C为Al2(SO4)3,D为(NH4)2CO3,
(1)A为NaOH,阴离子为OH-,电子式为
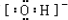 ,B中阳离子为Ba2+,故答案为:
,B中阳离子为Ba2+,故答案为: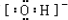 ;Ba2+;
;Ba2+; (2)由上述分析可知,C为Al2(SO4)3,D为(NH4)2CO3,故答案为:Al2(SO4)3;(NH4)2CO3;
(3)以Pt为电极电解1L0.1mol/LB氯化钡的水溶液,反应生成氢气和氯气,当电路中通过0.1mol电子时,溶液中生成0.05mol氢气,同时生成0.1mol氢氧根离子,氢氧根离子浓度为0.1mol/L,溶液的pH为13;阳极氯离子失去电子发生氧化反应,电极反应式为:2Cl--2e-=Cl2,
故答案为:13; 2Cl--2e-=Cl2;
(4)②中沉淀溶解的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O.
点评:本题考查物质的鉴别和检验,为高频考点,把握物质的性质及混合时的现象推断物质为解答的关键,综合考查元素化合物知识和离子反应,题目难度不大.

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
下列反应达到平衡后,增大压强或升高温度,平衡都向正反应方向移动的是( )
| A、2NO2(g)?N2O4(g) (正反应为放热反应) |
| B、3O2 (g)?2O3(g) (正反应为吸热反应) |
| C、H2(g)+I2(g)?2 H I(g)(正反应为放热反应) |
| D、NH4HCO3(s)?NH3(g)+H2O(g)+CO2(g) (正反应为吸热反应) |


 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示.请认真观察下图,然后回答问题.
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示.请认真观察下图,然后回答问题.


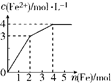 在Fe(NO3)3和Cu(NO3)2的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示.则该溶液中Fe(NO3)3与Cu(NO3)2的物质的量浓度之比为( )
在Fe(NO3)3和Cu(NO3)2的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示.则该溶液中Fe(NO3)3与Cu(NO3)2的物质的量浓度之比为( )