题目内容
下列关于物质的性质与用途的说法中不正确的是( )
| A、氧化铝的熔点很高,因此可用做耐火材料 |
| B、氯气具有强氧化性,因此可用于漂白棉、麻、纸张 |
| C、氨很容易液化,因此可用作制冷剂 |
| D、某些金属或它们的化合物灼烧时有特殊的颜色,因此可用于制造烟花 |
考点:镁、铝的重要化合物,氯气的化学性质,氨的物理性质,焰色反应
专题:化学应用
分析:A、氧化铝熔点高,用于制各种耐火砖、耐火坩埚、耐火管、耐高温实验仪器;
B、氯气和水反应生成的次氯酸具有漂白作用;
C、氨气易液化,液化过程是吸热的过程;
D、金属元素灼烧发生焰色反应.
B、氯气和水反应生成的次氯酸具有漂白作用;
C、氨气易液化,液化过程是吸热的过程;
D、金属元素灼烧发生焰色反应.
解答:
解:A、氧化铝熔点高,用于制各种耐火砖、耐火坩埚、耐火管、耐高温实验仪器,因此可用做耐火材料,故A正确;
B、氯气和水反应生成的次氯酸具有漂白作用,氯气本身无漂白作用,故B错误;
C、氨气易液化,液化过程是吸热的过程,故液氨可用作制冷剂,故C正确;
D、金属元素灼烧发生焰色反应,则金属或它们的化合物灼烧时有特殊的颜色,因此可用于制造烟花,故D正确;
故选B.
B、氯气和水反应生成的次氯酸具有漂白作用,氯气本身无漂白作用,故B错误;
C、氨气易液化,液化过程是吸热的过程,故液氨可用作制冷剂,故C正确;
D、金属元素灼烧发生焰色反应,则金属或它们的化合物灼烧时有特殊的颜色,因此可用于制造烟花,故D正确;
故选B.
点评:本题考查了氧化铝、氨气、氯气性质的应用,金属元素的焰色反应应用,掌握物质性质是解题关键,题目较简单.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案
相关题目
实验是化学研究的基础.下列关于各实验装置的叙述正确的是( )


| A、装置①常用于分离乙醇或苯等与水组成的混合物 |
| B、装置②可用于吸收NH3或HCl气体,并防止倒吸 |
| C、装置③可用于收集H2、CO2、Cl2、NO等气体 |
| D、装置④可用于干燥、收集氨气,并吸收多余的氨气 |
下列有关实验装置进行的相应实验,能达到实验目的是( )
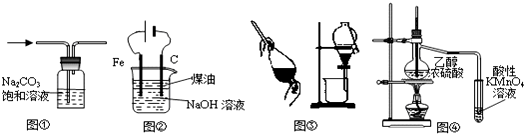

| A、图①除去CO2中的HCl |
| B、图②装置制备Fe(OH)2并能较长时间观察其颜色 |
| C、图③装置可用于分离C2H5OH和H2O的混合物 |
| D、图④证明CH3CH2OH发生消去反应生成了乙烯 |
青海昆仑玉被定为08北京奥运会奖牌用玉,昆仑玉主要成分是由“透闪石”和“阳起石”组成的纤维状微晶结合体,透闪石的化学成份为Ca2Mg5Si8O22(OH)2.下列有关说法不正确的是( )
| A、透闪石的化学式写成氧化物的形式为:2CaO?5MgO?8SiO2?H2O |
| B、透闪石的化学式写成硅酸盐的形式为:2CaSiO3?5MgSiO3?H2SiO3 |
| C、透闪石中Mg元素的质量分数是Ca元素质量分数的2倍 |
| D、透闪石中还可能有少量的Al代替Mg,Na、K、Mn代替Ca、Mg等 |
用10mL 0.1mol/L的BaCl2溶液可分别使相同体积的Fe2(SO4)3、ZnSO4和K2SO4三种溶液中的SO42-完全转化为BaSO4沉淀,则三种硫酸盐溶液的物质的量浓度之比是( )
| A、3:2:2 |
| B、1:2:3 |
| C、1:3:3 |
| D、3:1:1 |

 如图为10mL一定物质的量浓度的盐酸(HCl),用一定浓度的NaOH溶液滴定的图示,依据图示推出HCl和NaOH的物质的量浓度是( )
如图为10mL一定物质的量浓度的盐酸(HCl),用一定浓度的NaOH溶液滴定的图示,依据图示推出HCl和NaOH的物质的量浓度是( )