题目内容
12.有X、Y、Z三种金属,将X、Y、Z分别加入到相同的稀盐酸溶液中,只有Y表面产生气泡;另将X加入到Z的硝酸盐溶液中,无明显现象产生.由此判断金属活动性顺序正确的是( )| A. | X>Y>Z | B. | Z>Y>X | C. | Y>Z>X | D. | Y>X>Z |
分析 在金属活动性顺序中,位于氢前面的金属能置换出酸中的氢,位于前面的金属能把排在它后面的金属从其盐溶液中置换出来,以此可确定金属活动的顺序.
解答 解:将X、Y、Z分别加入到相同的稀盐酸溶液中,只有Y表面产生气泡,说明Y的活泼性较强,可与酸反应生成氢气,而X、Z的活泼性较弱;另将X加入到Z的硝酸盐溶液中,无明显现象产生,说明X不能置换出Z,则Z的活泼性大于X,正确顺序为Y>Z>X,
故选C.
点评 本题考查金属活动性顺序的判断,为高频考点,侧重考查学生的分析能力,注意把握物质的性质以及判断的角度,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.将盛有20mL NO和NO2混合气体的量筒倒立于水槽中,反应后气体体积缩小为15mL,则原混合气体中NO和NO2的体积比是( )
| A. | 4:1 | B. | 3:2 | C. | 5:3 | D. | 1:4 |
3.下列属于强电解质的是( )
| A. | NaCl溶液 | B. | HClO | C. | NaOH | D. | 蔗糖 |
20. 根据以下背景资料,回答下列问题:
根据以下背景资料,回答下列问题:
Ⅰ、不锈钢以其优异的抗腐蚀性能越来越受到人们的靑睐,它主要是由铁、铬、镍、铜、碳等元索所组成的合金.
Ⅱ、锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛.
Ⅲ、K2Cr2O7曾用于检测司机是否酒后驾驶:
Cr2O72-(橙色)+CH3CH2OH→Cr3+(绿色)+CH3COOH (未配平)
(1)镍元素基态原子的电子排布式为1s22s22p63s23p63d84s2或[Ar]3d84s2.
(2)CH3COOH分子中所含元素的电负性由大到小的顺序为O>C>H,碳原子的轨道杂化类型为sp3和sp2,所含σ键与π键的数目之比为7:1.
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因GeCl4、GeBr4、GeI4的熔、沸点依次增高,原因是分子结构相似,分子量依次增大,分子间相互作用力逐渐增强.
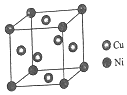
(4)某镍白铜合金的立方晶胞结构如图所示.
①晶胞中铜原子与镍原子的数量比为3:1.
②若合金的密度为dg/cm3,晶胞参数a=$\root{3}{\frac{251}{d{N}_{A}}}$×107nm.
 根据以下背景资料,回答下列问题:
根据以下背景资料,回答下列问题:Ⅰ、不锈钢以其优异的抗腐蚀性能越来越受到人们的靑睐,它主要是由铁、铬、镍、铜、碳等元索所组成的合金.
Ⅱ、锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛.
Ⅲ、K2Cr2O7曾用于检测司机是否酒后驾驶:
Cr2O72-(橙色)+CH3CH2OH→Cr3+(绿色)+CH3COOH (未配平)
(1)镍元素基态原子的电子排布式为1s22s22p63s23p63d84s2或[Ar]3d84s2.
(2)CH3COOH分子中所含元素的电负性由大到小的顺序为O>C>H,碳原子的轨道杂化类型为sp3和sp2,所含σ键与π键的数目之比为7:1.
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因GeCl4、GeBr4、GeI4的熔、沸点依次增高,原因是分子结构相似,分子量依次增大,分子间相互作用力逐渐增强.
| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | -49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
①晶胞中铜原子与镍原子的数量比为3:1.
②若合金的密度为dg/cm3,晶胞参数a=$\root{3}{\frac{251}{d{N}_{A}}}$×107nm.
7.锂(Li)是世界上最轻的金属,它属于碱金属的一种,下列说法正确的是( )
| A. | 和Li同一主族的都是金属元素 | B. | Na+比Li多一个电子层 | ||
| C. | Li、Na、K+的最外层都只有一个电子 | D. | Li是碱金属中原子半径最小的原子 |
17.4种相邻主族短周期元素的相对位置如表,元素X的原子核外电子数是M的2倍,Y的氧化物具有两性.回答下列问题:
(1)元素N在周期表中的位置是二周期VA族.
(2)X单质可采用电解熔融MgCl2的方法制备.
(3)M、N、Y三种元素最高价氧化物的水化物中,酸性最强的是HNO3,碱性最强的是Mg(OH)2(填化学式).二者反应的离子方程式为Mg(OH)2+2H+=Mg2++2H2O.
(4)气体分子(MN)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为(CN)2+2NaOH=NaCN+NaCNO+H2O.
| M | N | ||
| X | Y |
(2)X单质可采用电解熔融MgCl2的方法制备.
(3)M、N、Y三种元素最高价氧化物的水化物中,酸性最强的是HNO3,碱性最强的是Mg(OH)2(填化学式).二者反应的离子方程式为Mg(OH)2+2H+=Mg2++2H2O.
(4)气体分子(MN)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为(CN)2+2NaOH=NaCN+NaCNO+H2O.
2.下列反应中,属于加成反应的是( )
| A. | CH4+C12$\stackrel{光}{→}$ CH3Cl+HCl | |
| B. | CH2=CH2+H2O→CH3-CH2OH | |
| C. |  +Br2 $\stackrel{FeBr_{3}}{→}$ +Br2 $\stackrel{FeBr_{3}}{→}$  +HBr +HBr | |
| D. | 2 CH3CH2OH+O2$→_{△}^{Cu}$ 2 CH3CHO+2 H2O |