题目内容
4.下列各组离子能在溶液中大量共存的是( )| A. | Ag+、K+、NO${\;}_{3}^{-}$、Cl- | B. | Mg2+、Na+、Cl-、SO${\;}_{4}^{2-}$ | ||
| C. | Ca2+、Mg2+、OH-、Cl- | D. | H+、Na+、CO${\;}_{3}^{2-}$、NO${\;}_{3}^{-}$ |
分析 A.银离子与氯离子反应生成难溶物氯化银;
B.四种离子之间不发生反应,能够共存;
C.镁离子与氢氧根离子反应生成氢氧化镁沉淀;
D.氢离子与碳酸根离子发生反应.
解答 解:A.Ag+、Cl-之间反应生成氯化银沉淀,在溶液中不能大量共存,故A错误;
B.Mg2+、Na+、Cl-、SO42-之间不发生反应,在溶液中能够大量共存,故B正确;
C.Mg2+、OH-之间反应生成难溶物氢氧化镁,在溶液中不能大量共存,故C错误;
D.H+、CO32-之间发生反应,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的正误判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
1.聚碳酸酯 的透光率良好,可制作车、船、飞机的挡风玻璃,以及眼睛镜片、光盘、唱片等.原来合成聚碳酸酯的一种原料是用有毒的光气(又称碳酰氯COCl2),现在改用绿色化学原料碳酸二甲酯
的透光率良好,可制作车、船、飞机的挡风玻璃,以及眼睛镜片、光盘、唱片等.原来合成聚碳酸酯的一种原料是用有毒的光气(又称碳酰氯COCl2),现在改用绿色化学原料碳酸二甲酯  与哪类物质缩合聚合而成( )
与哪类物质缩合聚合而成( )
 的透光率良好,可制作车、船、飞机的挡风玻璃,以及眼睛镜片、光盘、唱片等.原来合成聚碳酸酯的一种原料是用有毒的光气(又称碳酰氯COCl2),现在改用绿色化学原料碳酸二甲酯
的透光率良好,可制作车、船、飞机的挡风玻璃,以及眼睛镜片、光盘、唱片等.原来合成聚碳酸酯的一种原料是用有毒的光气(又称碳酰氯COCl2),现在改用绿色化学原料碳酸二甲酯  与哪类物质缩合聚合而成( )
与哪类物质缩合聚合而成( )| A. | 二卤代物 | B. | 二酚类 | C. | 二醛类 | D. | 二烯类 |
12.元素性质的探究

(1)已知常温下氯酸钾与浓盐酸反应放出氯气,装置1不能(填“能”或“不能”)证明非金属性Cl>Br>I.若不能,请在装置1的实验基础上,再选择三种试剂来完成一个简单的实验,以弥补上述装置的不足,此三种试剂为溴水、碘化钾溶液、四氯化碳溶液(若能证明,此问可不作答)
(2)装置2中仪器①的名称为分液漏斗,若想用装置2来探究非金属性Cl>C>Si,则仪器①中所盛装的试剂为HClO4溶液.
(3)如图装置3将洁净的金属片放置在浸有某种盐溶液的滤纸上面并压紧(如图所示),可以形成原电池反应,利用连接在电路中的电压表可以探究原电池的电压与金属活动性的关系,实验所获数据如下.关于甲、乙、丙三种金属说法正确的是AD.
A.在三种金属中乙的还原性最强
B.金属甲能从硫酸铜溶液中置换出铜
C.乙、丙若形成原电池时,乙为正极
D.甲、乙形成合金时,将该合金露置在空气中,乙先被腐蚀.

(1)已知常温下氯酸钾与浓盐酸反应放出氯气,装置1不能(填“能”或“不能”)证明非金属性Cl>Br>I.若不能,请在装置1的实验基础上,再选择三种试剂来完成一个简单的实验,以弥补上述装置的不足,此三种试剂为溴水、碘化钾溶液、四氯化碳溶液(若能证明,此问可不作答)
(2)装置2中仪器①的名称为分液漏斗,若想用装置2来探究非金属性Cl>C>Si,则仪器①中所盛装的试剂为HClO4溶液.
| 金属 | 电压表指针偏转方向 | 电压/V |
| Al | 指向Cu | +0.78 |
| 甲 | 指向甲 | -0.15 |
| 乙 | 指向Cu | +1.35 |
| Fe | 指向Cu | +0.30 |
| 丙 | 指向Cu | +0.45 |
A.在三种金属中乙的还原性最强
B.金属甲能从硫酸铜溶液中置换出铜
C.乙、丙若形成原电池时,乙为正极
D.甲、乙形成合金时,将该合金露置在空气中,乙先被腐蚀.
19.某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:
在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色.
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含Br2(填化学式,下同)所致.
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含Fe3+所致.
(3)设计实验并验证:丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的.
供选用的试剂:a.酚酞试液 b.四氯化碳 c.无水酒精 d.硫氰化钾溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象.(试剂填序号)
(4)应用与拓展:
①在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生的离子反应方程式为2Fe2++Br2=2Fe3++2Br-.
②在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有1/3的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为1.2mol/L.
在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色.
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含Br2(填化学式,下同)所致.
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含Fe3+所致.
(3)设计实验并验证:丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的.
供选用的试剂:a.酚酞试液 b.四氯化碳 c.无水酒精 d.硫氰化钾溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象.(试剂填序号)
| 选用试剂 | 实验现象 | |
| 方案1 | ||
| 方案2 |
①在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生的离子反应方程式为2Fe2++Br2=2Fe3++2Br-.
②在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有1/3的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为1.2mol/L.
9.分枝酸可用于生化研究,其结构简式如图.下列关于分枝酸的叙述正确的是( )


| A. | 可与乙醇、乙酸反应,且反应类型相同 | |
| B. | 分子中含有2种官能团 | |
| C. | 1mol分枝酸最多可与3molNaOH发生中和反应 | |
| D. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同 |
16.柠檬烯是一种食用香料,其结构简式如图 所示.有关柠檬烯的分析正确的是( )
所示.有关柠檬烯的分析正确的是( )
 所示.有关柠檬烯的分析正确的是( )
所示.有关柠檬烯的分析正确的是( )| A. | 它的一氯代物有6种 | |
| B. | 一定条件下,它分别可以发生加成、取代、氧化等反应 | |
| C. | 它的分子中所有的碳原子可能在同一平面上 | |
| D. | 它和丁基苯( )互为同分异构体 )互为同分异构体 |
13.下列有关氧元素及其化合物的表示正确的是( )
| A. | 质子数为8、中子数为10的氧原子:${\;}_{8}^{18}$O | |
| B. | Ga的原子结构简图 | |
| C. | 水分子的电子式: | |
| D. | 乙酸甲酯的结构简式:HCOOC2H5 |
14.将固体NH4Br置于密闭容器中,在某温度下,发生下列反应:NH4Br(s)═NH3(g)+HBr(g),2HBr(g)?Br2(g)+H2(g).2min时,测知H2的浓度为0.5mol•L-1,HBr的浓度为4mol•L-1,若上述反应速率用v(NH3)表示,下列速率正确的是( )
| A. | 0.5mol•L-1•min-1 | B. | 2.5mol•L-1•min-1 | ||
| C. | 2mol•L-1•min-1 | D. | 5mol•L-1•min-1 |

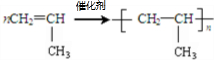 ;反应类型加聚反应.
;反应类型加聚反应.