题目内容
8.有如图所示装置:
(1)装置A为燃料电池,其中b为负极,电极反应式为H2-2e-+2OH-=H2O;
(2)B装置中Cu为阳极,电极反应式为Cu-2e-=Cu2+;
(3)当铜片的质量变化了19.2g时,a极上消耗的O2在标准状况下体积为3.36 L.
分析 由图可知,A为燃料电池,b为负极,发生H2-2e-+2OH-=H2O,a为正极,正极反应为2H2O+O2+4e-=4OH-;B中Cu与正极相连为阳极,阳极Cu失去电子,结合O2~4e-~2Cu计算.
解答 解:(1)装置A为燃料电池,其中b为负极,电极反应为H2-2e-+2OH-=H2O,故答案为:负;H2-2e-+2OH-=H2O;
(2)B中Cu与正极相连为阳极,阳极Cu失去电子,电极反应为Cu-2e-=Cu2+,故答案为:阳;Cu-2e-=Cu2+;
(3)由电子守恒可知,O2~4e-~2Cu,则铜片的质量变化了19.2g时,a极上消耗的O2在标准状况下体积为$\frac{19.2g}{64g/mol}$×$\frac{1}{2}$×22.4L/mol=3.36L,故答案为:3.36.
点评 本题考查原电池原理及应用,为高频考点,把握电极、电极反应及转移电子计算为解答的关键,侧重分析与应用能力的考查,注意电子守恒应用,题目难度不大.

练习册系列答案
相关题目
18.用化学方法除去下列物质中的杂质(括号内为杂质),填写所加试剂和有关离子反应方程式.
| 试剂 | 离子反应方程式 | |
| ①Mg(Al) | ||
| ②FeCl2溶液(FeCl3) | ||
| ③NaHCO3(Na2CO3) |
19.下列微粒中,电子层结构完全相同的一组是( )
| A. | S2-、Cl-、K+ | B. | Cl-、Br-、I- | C. | Na+、Mg2+、Cl- | D. | O2-、Mg2+、Cl- |
16.2007年诺贝尔化学奖授予善于做“表面文章”的德国科学家格哈德•埃特尔.他的成就之一是证实了气体在固体催化剂表面进行的反应,开创了表面化学的方法论.在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示.下列说法正确的是( )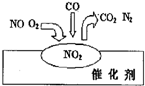

| A. | NO2是该过程的最终产物 | |
| B. | NO和O2必须在催化剂表面才能反应 | |
| C. | 汽车尾气的主要污染成分是CO2和NO | |
| D. | 该催化转化的总反应方程式为:2NO+O2+4CO$\frac{\underline{\;催化剂\;}}{\;}$ 4CO2+N2 |
3. 2015年10月5日,中国著名药学家屠呦呦获得诺贝尔奖生理学或医学奖,获奖理由是“因为发现青蒿素-一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”.从植物黄花蒿茎 叶中提取的,其结构简式如图,下列说法不正确的是( )
2015年10月5日,中国著名药学家屠呦呦获得诺贝尔奖生理学或医学奖,获奖理由是“因为发现青蒿素-一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”.从植物黄花蒿茎 叶中提取的,其结构简式如图,下列说法不正确的是( )
 2015年10月5日,中国著名药学家屠呦呦获得诺贝尔奖生理学或医学奖,获奖理由是“因为发现青蒿素-一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”.从植物黄花蒿茎 叶中提取的,其结构简式如图,下列说法不正确的是( )
2015年10月5日,中国著名药学家屠呦呦获得诺贝尔奖生理学或医学奖,获奖理由是“因为发现青蒿素-一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”.从植物黄花蒿茎 叶中提取的,其结构简式如图,下列说法不正确的是( )| A. | 它的分子式为C15H2205 | |
| B. | 青蒿素易发生加成反应和氧化反应 | |
| C. | 青蒿素在碱性条件下易发生水解反应 | |
| D. | 它在常见有机溶剂中的溶解度大于在水中的溶解度 |
13.在由水电离产生的c(H+)=1×10-14mol/L的无色溶液中,一定可以大量共存的离子组是( )
| A. | K+、Na+、HCO3-、SO42- | B. | K+、Cu2+、Cl-、NO3- | ||
| C. | NH4+、Al3+、Br-、SO42- | D. | Na+、Ba2+、Cl-、NO3- |
20.下列离子方程式的书写正确的是( )
| A. | 实验室用大理石和稀盐酸制取CO2:2H++CO32-═CO2↑+H2O | |
| B. | 铜和稀硝酸反应:Cu+2H+═H2↑+Cu2+ | |
| C. | 向AlCl3溶液中加入过量的NaOH溶液:Al3++3OH-═Al(OH)3↓ | |
| D. | NaHCO3溶液与NaOH溶液反应:OH-+HCO3-═CO32-+H2O |
17.Q、W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,X的焰色呈黄色.五种元素核电荷数之和为54,最外层电子数之和为20.W、Z最外层电子数相同,Z的核电荷数是W的2倍.工业上一般通过电解氧化物的方法获得Y的单质.则下列说法不正确的是( )
| A. | 原子半径:X>Y>Q>W | |
| B. | Q和W可形成原子个数比为1:1和2:1的化合物 | |
| C. | X 与W能形成两种常见的化合物 | |
| D. | Y单质既能与盐酸反应,又能与氢氧化钠溶液反应 |