题目内容
7.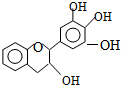 “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC下列叙述中正确的是( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC下列叙述中正确的是( )| A. | 分子中所有的原子不可能完全共面 | B. | 1molEGC与4molNaOH恰好完全反应 | ||
| C. | 易发生水解反应和取代反应 | D. | 遇FeCl3溶液发生显色反应 |
分析 该分子中含有苯环、醚键、醇羟基和酚羟基,具有苯、醚、醇和酚的性质,能发生加成反应、消去反应、取代反应、氧化反应、酯化反应等,以此解答该题.
解答 解:A.含有亚甲基,所以所有原子不能共面,故A正确;
B.酚羟基能和氢氧化钠反应,所以1molEGC与3molNaOH恰好完全反应,故B错误;
C.不能发生水解反应,故C错误;
D.含有酚羟基,所以能和氯化铁溶液发生显色反应,故D正确;
故选AD.
点评 本题考查有机物结构和性质,为高频考点,把握官能团及其性质关系是解本题关键,侧重考查酚的性质,注意该物质中不含酯基,为易错点.

练习册系列答案
相关题目
17.如图所示,其中甲池的总反应式为 2CH3OH+3O2+4KOH═2K2CO3+6H2O.下列说法正确的是( ) 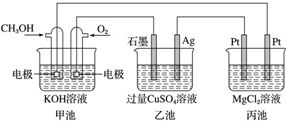

| A. | 甲池是电能转化为化学能的装置,乙、丙池是化学能转化为电能的装置 | |
| B. | 甲池通入 CH3OH 的电极反应式为 CH3OH-6e-+2H2O═CO23-+8H+ | |
| C. | 反应一段时间后,向乙池中加入一定量 Cu(OH)2固体能使 CuSO4溶液恢复到原浓度 | |
| D. | 甲池中消耗 280 mL(标准状况下)O2,此时丙池中理论上最多产生 1.45 g 固体 |
18.在四个不同的容器中,在不同条件下进行合成氨反应:N2+3H2?2NH3,在相同时间内,生成氨的反应速率最快的是( )
| A. | v ( N2)=0.2mol/(L•min) | B. | v ( N2)=0.1mol/(L•min) | ||
| C. | v ( NH3)=0.1mol/(L•min) | D. | v (H2)=0.3mol/(L•min) |
15.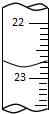 某化学实验小组用0.2000 mol/L的酸性KMnO4溶液测定草酸晶体的纯度(草酸晶体化学式为H2C2O4•2H2O,杂质不与KMnO4反应).实验步骤如下:
某化学实验小组用0.2000 mol/L的酸性KMnO4溶液测定草酸晶体的纯度(草酸晶体化学式为H2C2O4•2H2O,杂质不与KMnO4反应).实验步骤如下:
(1)称取13.0 g草酸晶体,配成250 mL水溶液.此操作过程必须用到的2种定量仪器是托盘天平和250mL容量瓶.
(2)量取草酸溶液25.00 mL放入锥形瓶中,用0.2000 mol/L的酸性KMnO4溶液滴定.
①配平离子方程式:MnO${\;}_{4}^{-}$+H2C2O4+H+→Mn2++CO2↑+H2O
②滴定达到终点的标志是加入最后一滴高锰酸钾溶液,锥形瓶内溶液由无色变为红色,且半分钟不褪色.
(3)按正确操作测得有关数据记录如下:
①a的读数如图所示,则a=22.80;
②草酸晶体的纯度为98.86%(结果保留两位小数).
(4)在上述实验中,下列操作(其它操作正确)一定会造成测定结果偏低的是C.
A.称取13.0 g草酸晶体时,将草酸晶体放在托盘天平右盘
B.锥形瓶水洗后未用草酸溶液润洗
C.读取KMnO4溶液体积时,开始仰视读数,滴定结束时俯视读数
D.盛KMnO4溶液的酸式滴定管尖嘴部分有气泡,滴定后气泡消失.
 某化学实验小组用0.2000 mol/L的酸性KMnO4溶液测定草酸晶体的纯度(草酸晶体化学式为H2C2O4•2H2O,杂质不与KMnO4反应).实验步骤如下:
某化学实验小组用0.2000 mol/L的酸性KMnO4溶液测定草酸晶体的纯度(草酸晶体化学式为H2C2O4•2H2O,杂质不与KMnO4反应).实验步骤如下:(1)称取13.0 g草酸晶体,配成250 mL水溶液.此操作过程必须用到的2种定量仪器是托盘天平和250mL容量瓶.
(2)量取草酸溶液25.00 mL放入锥形瓶中,用0.2000 mol/L的酸性KMnO4溶液滴定.
①配平离子方程式:MnO${\;}_{4}^{-}$+H2C2O4+H+→Mn2++CO2↑+H2O
②滴定达到终点的标志是加入最后一滴高锰酸钾溶液,锥形瓶内溶液由无色变为红色,且半分钟不褪色.
(3)按正确操作测得有关数据记录如下:
| 滴定次数 | 草酸溶液体积 | 酸性KMnO4溶液体积 | |
| 滴定前读数/mL | 滴定后读数/mL | ||
| 第一次 | 25.00 | 0.20 | 20.58 |
| 第二次 | 25.00 | 4.00 | 24.40 |
| 第三次 | 25.00 | 2.38 | a |
②草酸晶体的纯度为98.86%(结果保留两位小数).
(4)在上述实验中,下列操作(其它操作正确)一定会造成测定结果偏低的是C.
A.称取13.0 g草酸晶体时,将草酸晶体放在托盘天平右盘
B.锥形瓶水洗后未用草酸溶液润洗
C.读取KMnO4溶液体积时,开始仰视读数,滴定结束时俯视读数
D.盛KMnO4溶液的酸式滴定管尖嘴部分有气泡,滴定后气泡消失.
2.下列化学用语正确的是( )
| A. | 中子数为8的碳原子:814C | B. | 氟离子的结构示意图: | ||
| C. | 二氧化碳的结构式:O=C=O | D. | N2的电子式: |
12.下列离子方程式中,错误的是( )
| A. | 将氨通入盐酸中:NH3+H+=NH4+ | |
| B. | 在稀NaOH溶液中滴入几滴NH4Cl溶液:NH4++OH-=NH3↑+H2O | |
| C. | 将少量铜屑放入浓硝酸中:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O | |
| D. | 将稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑ |
19.将Mg、Cu组成的26.4g混合物投入到适量的稀硝酸中,固体完全溶解,将产生的气体和6.72L(标准状况下)氧气混合通入水中,恰好全部被水吸收.向反应后的溶液中加入足量4mol/L-1的NaOH溶液,使金属离子完全沉淀.则形成沉淀的质量是( )
| A. | 63.8 g | B. | 53.6 g | C. | 46.8 g | D. | 43.2 g |
2.常温下体积为1ml、浓度均为0.10mol/L的XOH和X2CO3溶液分别加水稀释至体积为V,pH随lgV的变化情况如图所示,下列叙述中正确的是( 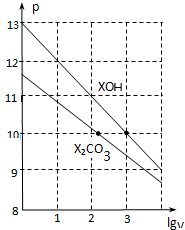

| A. | pH=10的两种溶液中的c(X+):XOH大于X2CO3 | |
| B. | 已知常温下,0.1 mol•L-1 XHCO3溶液的pH=8.31,则Ka1(H2CO3)•Ka2(H2CO3)>Kw | |
| C. | 已知H2CO3的电离平衡常数Ka1远远大于Ka2,则Ka2约为1.0×10-10.2 | |
| D. | 当lgV=2时,若X2CO3溶液升高温度,溶液碱性增强,则$\frac{c(HC{{O}_{3}}^{-})}{c(C{{O}_{3}}^{2-})}$减小 |
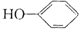 合成
合成 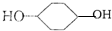
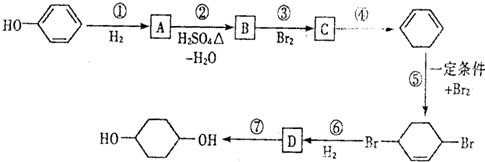
 ,D
,D .
.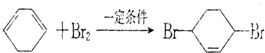 写出在同样条件下CH2=CH-CH=CH2与等物质的量Br2发生加成反应的化学反应方程式
写出在同样条件下CH2=CH-CH=CH2与等物质的量Br2发生加成反应的化学反应方程式 .
.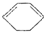 的反应方程式(有机物写结构简式,注明反应条件).
的反应方程式(有机物写结构简式,注明反应条件). .
.