题目内容
1.A、B、C、D、E五种短周期元素,原子序数E>D>A>B>C,且A、B同周期,C、D同主族,A的原子结构示意图为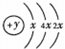 ,B、C可形成离子化合物B3C2,E是同周期元素中原子半径最小的元素.
,B、C可形成离子化合物B3C2,E是同周期元素中原子半径最小的元素.(1)A元素在周期表中的位置是第三周期ⅣA族,其在气态氢化物的化学式为SiH4.
(2)C的气态氢化物与E的气态氢化物相遇时的反应现象是产生白烟,产物的电子式为
 .
.(3)A、B、C、D四种元素的原子半径由小到大的顺序为N<P<Si<Mg.(用元素符号表示)
(4)B和C最高价氧化物对应水化物的化学式分别为Mg(OH)2和HNO3.
分析 A、B、C、D、E五种短周期元素,原子序数E>D>A>B>C,A的原子结构示意图为 ,故x=2,则A为Si;E是同周期元素中原子半径最小的元素,结合原子序数可知E处于第三周期,故E为Cl;B、C可形成离子化合物B3C2,应是Mg3N2,则B为Mg、C为N;C、D同主族,则D为P,据此解答.
,故x=2,则A为Si;E是同周期元素中原子半径最小的元素,结合原子序数可知E处于第三周期,故E为Cl;B、C可形成离子化合物B3C2,应是Mg3N2,则B为Mg、C为N;C、D同主族,则D为P,据此解答.
解答 解:A、B、C、D、E五种短周期元素,原子序数E>D>A>B>C,A的原子结构示意图为 ,故x=2,则A为Si;E是同周期元素中原子半径最小的元素,结合原子序数可知E处于第三周期,故E为Cl;B、C可形成离子化合物B3C2,应是Mg3N2,则B为Mg、C为N;C、D同主族,则D为P.
,故x=2,则A为Si;E是同周期元素中原子半径最小的元素,结合原子序数可知E处于第三周期,故E为Cl;B、C可形成离子化合物B3C2,应是Mg3N2,则B为Mg、C为N;C、D同主族,则D为P.
(1)A为Si元素,在周期表中的位置是第三周期ⅣA族,其在气态氢化物的化学式为SiH4,
故答案为:第三周期ⅣA族;SiH4;
(2)C、E气态氢化物分别为NH3、HC,二者相遇反应生成NH4Cl,产生白烟,NH4Cl电子式为: ,
,
故答案为:产生白烟; ;
;
(3)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:N<P<Si<Mg,
故答案为:N<P<Si<Mg;
(4)B和C最高价氧化物对应水化物的化学式分别为Mg(OH)2、HNO3,
故答案为:Mg(OH)2;HNO3.
点评 本题考查结构性质位置关系应用,侧重对化学用语与元素周期律的考查,比较基础.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11. 对硫-氮化合物的研究是现代无机化学最为活跃的领域之一,如图是已经合成的最著名的硫-氮化合物的分子结构.下列关于该物质说法正确的是( )
对硫-氮化合物的研究是现代无机化学最为活跃的领域之一,如图是已经合成的最著名的硫-氮化合物的分子结构.下列关于该物质说法正确的是( )
 对硫-氮化合物的研究是现代无机化学最为活跃的领域之一,如图是已经合成的最著名的硫-氮化合物的分子结构.下列关于该物质说法正确的是( )
对硫-氮化合物的研究是现代无机化学最为活跃的领域之一,如图是已经合成的最著名的硫-氮化合物的分子结构.下列关于该物质说法正确的是( )| A. | 分子式为SN | |
| B. | 分子中既有极性键又有非极性键 | |
| C. | 分子中所有共价键的键长一定相等 | |
| D. | 该物质与化合物S2N2互为同素异形体 |
12.(1)现有分子式均为C3H6O2的四种有机物A、B、C、D,且分子中均含甲基,把它们分别进行下列实验加以鉴别,实验记录如下:
则A、B、C、D的结构简式分别为:ACH3CH2COOH;BCH3CH(OH)CHO;CHCOOCH2CH3;DCH3COOCH3.
(2)已知葡萄糖在乳酸菌作用下可转化为乳酸(C3H6O3),取9g乳酸与足量金属Na反应,可生成2.24LH2(标准状况),另取同量乳酸与同物质的量的乙醇反应,生成0.1mol乳酸乙脂和1.8g水;乳酸在Cu作催化剂时可被氧化成丙酮酸(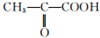 ),由以上事实推知乳酸的结构简式为CH3CH(OH)COOH.
),由以上事实推知乳酸的结构简式为CH3CH(OH)COOH.
(3)两个乳酸分子在一定条件下脱水生成环酯(C6H8O4),则此环酯的结构简式是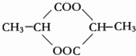 .
.
| NaOH溶液 | 银氨溶液 | 新制Cu(OH)2悬浊液 | 金属钠 | |
| A | 中和反应 | - | 溶解 | 产生氢气 |
| B | - | 有银镜 | 加热后有砖红色沉淀 | 产生氢气 |
| C | 水解反应 | 有银镜 | 加热后有砖红色沉淀 | - |
| D | 水解反应 | - | - | - |
(2)已知葡萄糖在乳酸菌作用下可转化为乳酸(C3H6O3),取9g乳酸与足量金属Na反应,可生成2.24LH2(标准状况),另取同量乳酸与同物质的量的乙醇反应,生成0.1mol乳酸乙脂和1.8g水;乳酸在Cu作催化剂时可被氧化成丙酮酸(
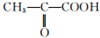 ),由以上事实推知乳酸的结构简式为CH3CH(OH)COOH.
),由以上事实推知乳酸的结构简式为CH3CH(OH)COOH.(3)两个乳酸分子在一定条件下脱水生成环酯(C6H8O4),则此环酯的结构简式是
 .
.
9.从金属利用的历史来看,先是青铜器时代,而后是铁器时代,铝的利用是近百年的事.这个先后顺序跟下列有关的是:①地壳中的金属元素的含量;②金属活动性;③金属的导电性;④金属冶炼的难易程度;⑤金属的延展性( )
| A. | ①③ | B. | ②④ | C. | ③⑤ | D. | ②⑤ |
16.根据原子结构及元素周期律的知识,下列推断正确的是( )
| A. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 | |
| B. | 核外电子排布相同的微粒化学性质也相同 | |
| C. | 同主族元素从上到下,单质的熔点逐渐降低 | |
| D. | 同族上下相邻两种元素的原子序数之差可能为32 |
6.反应A(g)+3B(g)?2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是
( )
( )
| A. | v(D)=0.40mol•L-1•s-1 | B. | v(C)=0.50mol•L-1•s_1 | ||
| C. | v(A)=0.30mol•L-1•s-1 | D. | v(B)=0.60mol•L-1•s-1 |
13.某单烯烃与H2加成后的产物是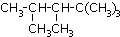 ,则该烯烃的结构式可能有( )
,则该烯烃的结构式可能有( )
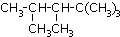 ,则该烯烃的结构式可能有( )
,则该烯烃的结构式可能有( )| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
10.设NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 1.7g OH- 所含电子数为0.9NA | |
| B. | 标准状况下,11.2 L HCl 所含质子数为18NA | |
| C. | 7.8gNa2O2固体中含有的离子数为4NA | |
| D. | 0.5 mol D2O 中所含质子数为5NA |
11.下列关于有机物的说法正确的是( )
| A. | 乙烯和苯都能使溴水褪色,褪色的原因相同 | |
| B. | 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 | |
| C. | 葡萄糖和果糖的分子式均为C6H12O6,二者互为同系物 | |
| D. | 乙醇、乙酸、乙酸乙酯都能发生取代反应,乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去 |