题目内容
已知NH4NO3受到撞击或受热时会发生爆炸性分解:2NH4NO3═4H2O↑+2N2↑+O2↑.在反应中,被还原的原子和被氧化的原子的物质的量之比是( )
| A、3:5 | B、1:1 |
| C、1:2 | D、2:1 |
考点:氧化还原反应的计算
专题:氧化还原反应专题
分析:在2NH4NO3═4H2O↑+2N2↑+O2↑的反应中,NH4+→N2,N元素的化合价由-3价→0价,NO3-→N2,N元素的化合价由+5价→0价,O元素化合价由-2价升高到0价,根据氧化还原反应中氧化剂和还原剂之间得失电子数目相等判断发生氧化反应的氮原子与发生还原反应的氮原子的个数之比.
解答:
解:在2NH4NO3═4H2O↑+2N2↑+O2↑的反应中,NH4+→N2,N元素的化合价由-3价→0价,NO3-→N2,N元素的化合价由+5价→0价,O元素化合价由-2价升高到0价,
假设有2mol NH4NO3参加反应,NO3-→N2,为被还原的过程,被还原的原子为2mol,
被NH4+→N2,NO3-→O2,为被氧化的过程,被氧化的原子共为4mol,
则在反应中,被还原的原子和被氧化的原子的物质的量之比是1:2.
故选C.
假设有2mol NH4NO3参加反应,NO3-→N2,为被还原的过程,被还原的原子为2mol,
被NH4+→N2,NO3-→O2,为被氧化的过程,被氧化的原子共为4mol,
则在反应中,被还原的原子和被氧化的原子的物质的量之比是1:2.
故选C.
点评:本题考查氧化还原反应的计算,题目难度不大,本题注意根据方程式判断元素的化合价的变化,判断N元素化合价的变化为解答该题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
有NaCl和MgCl2组成的混合物153.5g,溶于水配成1L溶液,此溶液中Cl-的物质的量浓度为3mol/L,则原混合物中的MgCl2的质量为( )
| A、95g | B、47.5g |
| C、58.5g | D、117g |
将3.48g Fe3O4完全溶解在100mL 1mol?L-1硫酸中,然后加入一定体积的0.1mol?L-1的K2Cr2O7溶液,恰好使溶液中Fe2+全部转化为Fe3+,Cr2O72-全部还原为Cr3+,则加入K2Cr2O7溶液的体积为( )
| A、15mL | B、25mL |
| C、35mL | D、50mL |
 在温度相同、浓度相同的条件下,下列六种物质的水溶液的pH由小到大的排列顺序如图所示.图中①、②、③可能是( )
在温度相同、浓度相同的条件下,下列六种物质的水溶液的pH由小到大的排列顺序如图所示.图中①、②、③可能是( )| A、NH4NO3、(NH4)2SO4、CH3COONa |
| B、(NH4)2SO4、NH4Cl、C6H5ONa |
| C、(NH4)2SO4、NH4NO3、Na2CO3 |
| D、(NH4)2SO4、NH4NO3、CH3COONa |
要除去下列四种物质中的少量杂质(括号内的物质为杂质):甲:CaCO3(Na2CO3);乙:NaOH(Na2CO3);丙:KCl(KHCO3);丁:碳粉(CuO)可选用的试剂及操作方法有:①加适量盐酸,搅拌,过滤;②加适量水,搅拌,过滤;③加适量盐酸,蒸发;④溶解,加适量石灰水,过滤,蒸发.下列组合正确的是( )
| A、甲-②,乙-④ |
| B、乙-③,丙-① |
| C、丙-①,丁-② |
| D、丁-②,丙-③ |
某反应过程中体系的能量变化如图所示,下列说法错误的是( )
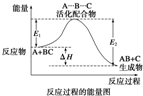

A、反应过程可表示为
| ||||||
| B、E1为反应物的平均能量与过渡态的能量差,称为正反应的活化能 | ||||||
| C、正反应的热效应为△H=E1-E2<0,所以正反应为放热反应 | ||||||
| D、此图中逆反应的热效应△H=E1-E2<0,所以逆反应为放热反应 |
下列各组离子在特定条件下一定能够大量共存的是( )
| A、含有较多Fe3+的溶液:Na+、SO42-、HS-、NH4+ |
| B、c(OH-)=1mol/L的溶液:AlO2-、CH3COO-、K+、Ba2+ |
| C、pH=1的溶液:K+、Fe2+、NO3-、Na+ |
| D、遇Al能放出H2的溶液:HCO3-、K+、Mg2+、Cl- |
 化学反应原理在工业生产中具有十分重要的意义.
化学反应原理在工业生产中具有十分重要的意义.