题目内容
下列说法正确的是( )
| A、增加气态反应物的物质的量,未必增大其反应速率 |
| B、增加硝酸的浓度可以加快锌与硝酸反应制氢气的速率 |
| C、增加CaCO3的量可以加速CaCO3的分解反应速率 |
| D、增加水的量或提高温度都可以加快镁和水的反应速率 |
考点:化学反应速率的影响因素
专题:
分析:影响化学反应速率的因素有温度、浓度、压强、催化剂以及接触面积等等,增大固态或纯液体的量对反应速率无影响,据此分析.
解答:
解:A、增大气态反应物的物质的量时,如果不能够增大反应物浓度,反应速率未必增大,故A正确;
B、硝酸与锌反应不生成氢气,故B错误;
C、碳酸钙是固态,增大质量不会影响反应速率,故C错误;
D、增大水的量不影响反应速率,故D错误;
故选A.
B、硝酸与锌反应不生成氢气,故B错误;
C、碳酸钙是固态,增大质量不会影响反应速率,故C错误;
D、增大水的量不影响反应速率,故D错误;
故选A.
点评:本题考查了影响反应速率的因素,注意增大固态或纯液体的量对反应速率无影响,题目难度不大.

练习册系列答案
相关题目
甲、乙、丙三种物质的溶解度曲线如图所示,下列说法错误的是( )


| A、50℃时,乙物质的溶解度是40g |
| B、30℃时,三种物质的溶解度:乙>甲>丙 |
| C、升温可使丙的不饱和溶液变饱和 |
| D、50℃时,将等质量的甲、丙两种物质的饱和溶液同时降温至10℃时,所得溶液的溶质质量分数:丙>甲 |
“人文奥运、科技奥运、绿色奥运”是2008年北京奥运会的重要特征.其中禁止运动员使用兴奋剂是重要举措之一.如图两种兴奋剂的结构分别为:则关于它们的说法中正确的是( )
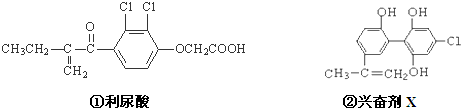
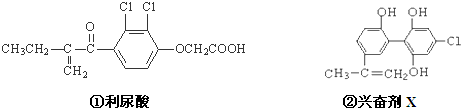
| A、利尿酸乙酯分子中有三种含氧官能团,在核磁共振氢谱上共有七个峰 |
| B、1 mol兴奋剂X与足量浓溴水反应,最多消耗4 mol Br2 |
| C、两种兴奋剂最多都能和含3molNaOH的溶液反应 |
| D、两种分子中的所有碳原子均不可能共平面 |
下列说法正确的是( )
| A、增大压强,化学反应速率一定增大 |
| B、化学反应速率为反应时间内反应物浓度的增加或者生成物浓度的减少 |
| C、升高温度,化学反应速率一定增大 |
| D、加入反应物,化学反应速率增大 |
下列反应中,氯元素被氧化的是( )
A、2KClO3
| ||||
B、2P+5Cl2
| ||||
C、MnO2+4HCl(浓)
| ||||
D、H2+Cl2
|
要求设计实验证明某种盐的水解是吸热的,有四位同学分别作出如下回答其中正确的是( )
| A、甲同学:将硝酸铵晶体溶于水,若水温下降,说明硝酸铵水解是吸热的 |
| B、乙同学:在醋酸溶液中加入碳酸氢铵粉末,若溶液温度下降,说明盐类水解是吸热的 |
| C、丙同学:在醋酸钠溶液中加入醋酸钠晶体,若溶液温度下降,说明盐类水解是吸热的 |
| D、丁同学:在醋酸钠溶液中滴入酚酞试液,加热后若红色加深,说明盐类水解是吸热的 |
 影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究.
影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究.