题目内容
10.现有下列短周期元素性质的数据,下列说法正确的是( )| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10 | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | -2 | +2 | +1 | +5,-3 | +7,-1 | +1 | +5,-3 | +3 |
| A. | ⑧号元素为Al | |
| B. | 上述八种元素最高价氧化物对应的水化物⑤号酸性最强 | |
| C. | ②、③处于同一周期 | |
| D. | ④元素的气态氢化物沸点大干⑦元素的氢化物 |
分析 短周期元素,④⑦都有最高价+5、最低价-3,处于ⅤA族,且原子半径④>⑦,故④为P、⑦为N;⑤有+7、-1价,则⑤为Cl;①有最低价-2,原子半径小于N,则①为O;⑧有最高价+3.处于ⅢA族,原子半径小于P,则⑧为B;②有最高价+2,处于ⅡA族,原子半径大于P,则②为Mg;③⑥都有+1价,处于ⅠA族,原子半径③<⑥,且③的原子半径不是最小,故③为Li、⑥为Na,据此解答.
解答 解:短周期元素,④⑦都有最高价+5、最低价-3,处于ⅤA族,且原子半径④>⑦,故④为P、⑦为N;⑤有+7、-1价,则⑤为Cl;①有最低价-2,原子半径小于N,则①为O;⑧有最高价+3.处于ⅢA族,原子半径小于P,则⑧为B;②有最高价+2,处于ⅡA族,原子半径大于P,则②为Mg;③⑥都有+1价,处于ⅠA族,原子半径③<⑥,且③的原子半径不是最小,故③为Li、⑥为Na,
A.由上述分析可知,⑧为B,故A错误;
B.⑤为Cl元素,高氯酸是最高价氧化物对应的水化物酸性最强的酸,故B正确;
C.②为Mg,③为Li,二者处于不同的周期,故C错误;
D.④为P、⑦为N,元素的非金属性越强,其氢化物越稳定,所以稳定性:④<⑦,故D错误,
故选B.
点评 本题考查结构性质位置关系应用,根据化合价与原子半径推断元素是解题关键,注意对元素周期律的掌握,题目难度中等,侧重于考查学生的分析能力和对基础知识的应用能力.

练习册系列答案
相关题目
20.NA为阿伏加罗常数的值,下列说法正确的是( )
| A. | 1.0L1.0mol•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 常温下,0.1mol碳酸钠晶体中含有CO32-的个数为0.1NA | |
| C. | 标准状况下,11.2L18O2中所含中子数为8NA | |
| D. | 25℃时,1LpH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA |
1.下列物质与硝酸反应,既体现了硝酸具有强氧化性又体现了酸性的是( )
| A. | Cu | B. | C | C. | CuO | D. | CuCO3 |
18.直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:SO2+H2O?H2SO3、2H2SO3+O2=2H2SO4;
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是2OH-+SO2=SO32-+H2O;
(3)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如表:
①上表判断NaHSO3溶液显酸性,用化学平衡原理解释HSO3-存在HSO3-?H++SO32-和HSO3-+H2O?H2SO3+OH-,HSO3-的电离程度大于水解程度;
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):ab;
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生.再生示意图如下:
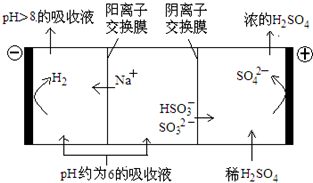
①HSO3-在阳极放电的电极反应式是HSO3-+H2O-2e-=SO42-+3H+;
②当阴极室中溶液PH升至8以上时,吸收液再生并循环利用.简述再生原理氢离子在阴极得电子生成氢气,溶液中氢离子浓度降低,促使HSO3-电离生成SO32-,且钠离子进入阴极室,吸收液就可以再生.
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:SO2+H2O?H2SO3、2H2SO3+O2=2H2SO4;
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是2OH-+SO2=SO32-+H2O;
(3)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):ab;
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生.再生示意图如下:

①HSO3-在阳极放电的电极反应式是HSO3-+H2O-2e-=SO42-+3H+;
②当阴极室中溶液PH升至8以上时,吸收液再生并循环利用.简述再生原理氢离子在阴极得电子生成氢气,溶液中氢离子浓度降低,促使HSO3-电离生成SO32-,且钠离子进入阴极室,吸收液就可以再生.
15.下列实验能达到预期目的是( )
| A. | 验证蔗糖水解产物时,在蔗糖溶液中加几滴稀硫酸,水浴5min,加入新制银氨溶液 | |
| B. | 检验溴乙烷中溴元素时,将溴乙烷和NaOH溶液混合,充分振荡静置后加AgNO3溶液 | |
| C. | 向淀粉溶液中加稀硫酸加热后,加NaOH中和并做银镜反应,检验淀粉是否水解 | |
| D. | 除去苯中混有的少量苯酚,加入浓溴水后过滤 |
2.同周期的两种主族元素A和B能够形成离子化合物AmBn,已知A的原子序数为a,则B的原子序数可能为( )
| A. | a+8+m-n | B. | a+16-m+n | C. | a+24-m-n | D. | a+18-m-n |
19.在元素周期表中,元素的金属性和非金属性及其强弱比较与周期序数(n)和主族序数(A)有如下经验公式:K=$\frac{A}{n}$(K为A与n的比值).下列推理正确的是( )
| A. | 当A一定时,K值越小,则元素的非金属性越强 | |
| B. | 当K=0,则该元素系同一周期中最活泼的金属元素 | |
| C. | 当n一定时,随着K值增大,则元素的非金属性逐渐增强 | |
| D. | 当K=l时,则该元素系过渡元素 |
2. 某研究性学习小组欲研究影响锌和稀硫酸反应速率的外界条件,下表是其实验设计的有关数据:
某研究性学习小组欲研究影响锌和稀硫酸反应速率的外界条件,下表是其实验设计的有关数据:
(1)在此5组实验中,判断锌和稀硫酸反应速率大小,最简单的方法可通过定量测定锌完全消失所需的时间进行判断,其速率最快的实验是5 (填实验序号).
(2)对锌和稀硫酸反应,实验1和2表明,固体反应物的表面积对反应速率有影响;实验1和3表明,(是否形成)原电池对反应速率有影响.
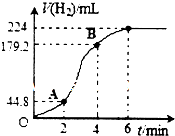
(3)进行实验2时,小组同学根据实验过程绘制的标准状况下的气体体积V与时间t的图象如右图所示.
①在OA、AB、BC三段中反应速率最快的是AB,原因是反应放热,使温度升高,反应速率加快.
②2~4min内以硫酸的浓度变化表示的反应速率(假设溶液的体积不变)=0.06mol•L-1•min-1.
 某研究性学习小组欲研究影响锌和稀硫酸反应速率的外界条件,下表是其实验设计的有关数据:
某研究性学习小组欲研究影响锌和稀硫酸反应速率的外界条件,下表是其实验设计的有关数据:| 实验 序号 | 锌的质量/g | 锌的 状态 | c(H2SO4)/mol•L-1 | V(H2SO4) /mL | 反应前溶液的温度/℃ | 添加剂 |
| 1 | 0.65 | 粒状 | 0.5 | 50 | 20 | 无 |
| 2 | 0.65 | 粉末 | 0.5 | 50 | 20 | 无 |
| 3 | 0.65 | 粒状 | 0.5 | 50 | 20 | 2滴CuSO4溶液 |
| 4 | 0.65 | 粉末 | 0.8 | 50 | 20 | 无 |
| 5 | 0.65 | 粉末 | 0.8 | 50 | 20 | 2滴CuSO4溶液 |
(2)对锌和稀硫酸反应,实验1和2表明,固体反应物的表面积对反应速率有影响;实验1和3表明,(是否形成)原电池对反应速率有影响.
(3)进行实验2时,小组同学根据实验过程绘制的标准状况下的气体体积V与时间t的图象如右图所示.
①在OA、AB、BC三段中反应速率最快的是AB,原因是反应放热,使温度升高,反应速率加快.
②2~4min内以硫酸的浓度变化表示的反应速率(假设溶液的体积不变)=0.06mol•L-1•min-1.
 已知甲酸(HCOOH)是羧酸中组成最简单的酸,它具有羧酸的性质,在实验室里常用甲酸在浓硫酸的作用下制取少量一氧化碳,现用甲酸与甲醇反应制取甲酸甲酯来验证甲酸具有能发生酯化反应的性质,装置如图所示.
已知甲酸(HCOOH)是羧酸中组成最简单的酸,它具有羧酸的性质,在实验室里常用甲酸在浓硫酸的作用下制取少量一氧化碳,现用甲酸与甲醇反应制取甲酸甲酯来验证甲酸具有能发生酯化反应的性质,装置如图所示.