题目内容
根据要求写出下列反应的热化学方程式
(1)一定量氢气与氯气反应生成氯化氢气体,当生成1mol氢氯键时放出91.5kJ的热量 .
(2)某化学反应的能量变化如图所示,该反应的热化学方程式是(反应热用abc表示) .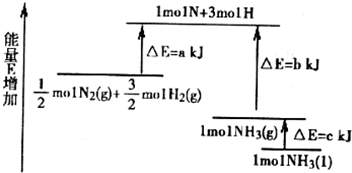
(3)某反应的平衡常数K=
如果有1molN2 完全反应,要吸收热量68kJ.写出该反应的热化学方程式 .
(4)实验中不能直接测出石墨和氢气生成甲烷反应的反应热,但可测出甲烷、石墨、氢气燃烧的反应热:
CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H1=-890.3kJ/mol C(石墨,s)+O2(g)=CO2(g);△H2=-393.5kJ/mol
H2(g)+1/2O2(g)=H2O(l);△H3=-285.8kJ/moL则由石墨与氢气反应生成甲烷的热化学反应方程式为 .
(1)一定量氢气与氯气反应生成氯化氢气体,当生成1mol氢氯键时放出91.5kJ的热量
(2)某化学反应的能量变化如图所示,该反应的热化学方程式是(反应热用abc表示)

(3)某反应的平衡常数K=
| C2(NO2) |
| C(N2)C2(O2) |
(4)实验中不能直接测出石墨和氢气生成甲烷反应的反应热,但可测出甲烷、石墨、氢气燃烧的反应热:
CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H1=-890.3kJ/mol C(石墨,s)+O2(g)=CO2(g);△H2=-393.5kJ/mol
H2(g)+1/2O2(g)=H2O(l);△H3=-285.8kJ/moL则由石墨与氢气反应生成甲烷的热化学反应方程式为
考点:有关反应热的计算,热化学方程式
专题:化学反应中的能量变化
分析:(1)氢气与氯气反应生成氯化氢气体,当生成1mol氢氯键时即生成1molHCl放出91.5kJ,据热化学方程式的意义和书写知识来回答;
(2)根据反应热等于反应物总能量减去生成物总能量计算反应热,然后根据并热化学方程式的书写方法写出热化学方程式,注意反应物的物质的量和生成物的聚集状态;
(3)根据平衡常数来确定化学方程式,根据系数和焓变的关系确定焓变;
(4)根据盖斯定律来计算反应的焓变并书写热化学方程式.
(2)根据反应热等于反应物总能量减去生成物总能量计算反应热,然后根据并热化学方程式的书写方法写出热化学方程式,注意反应物的物质的量和生成物的聚集状态;
(3)根据平衡常数来确定化学方程式,根据系数和焓变的关系确定焓变;
(4)根据盖斯定律来计算反应的焓变并书写热化学方程式.
解答:
解:(1)生成1mol氢氯键时即生成1molHCl放出91.5kJ,生成2mol氢氯键时即生成1molHCl放出183kJ,即H2(g)+Cl2(g)=2HCl(g),△H=-183kJ/mol,故答案为:H2(g)+Cl2(g)=2HCl(g),△H=-183kJ/mol;
(2)由图可以看出,△E为反应的活化能,反应热等于反应物的活化能减生成物的活化能,所以
N2(g)+
H2(g)=NH3(g)△H=(a-b)kJ/mol,即N2(g)+3H2(g)═2NH3(g);△H=-2(b-a) kJ/mol,故BD错误;而1mol的NH3(g)转化为1mol的NH3(l)放出的热量为ckJ,根据盖斯定律有:
N2(g)+
H2(g)=NH3(l)△H=(a-b-c)kJ/mol,即:N2(g)+3H2(g)=2NH3(1)△H=2(a-b-c)kJ?mol-1,
故答案为:N2(g)+3H2(g)=2NH3(1)△H=2(a-b-c)kJ?mol-1;
(3)根据某反应的平衡常数K=
知道该反应为:N2(g)+2O2(g)=2NO2(g),如果有1molN2 完全反应,要吸收热量68kJ,即N2(g)+2O2(g)=2NO2(g)△H=+68kJ/mol,
故答案为:N2(g)+2O2(g)=2NO2(g)△H=+68kJ/mol;
(4)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H1=-890.3kJ/mol;
②C(石墨,s)+O2(g)=CO2(g);△H2=-393.5kJ/mol
③H2(g)+
O2(g)=H2O(l);△H3=-285.8kJ/moL,反应C(石墨,s)+2H2(g)=CH4(g)可以是②+2×③-①得到,所以焓变△H=(-393.5kJ/mol
)+2×(-285.8kJ/moL)-(-890.3kJ/mol)=-74.8kJ/mol,即C(石墨,s)+2H2(g)=CH4(g)△H=-74.8kJ/mol,
故答案为:C(石墨,s)+2H2(g)=CH4(g)△H=-74.8kJ/mol.
(2)由图可以看出,△E为反应的活化能,反应热等于反应物的活化能减生成物的活化能,所以
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
故答案为:N2(g)+3H2(g)=2NH3(1)△H=2(a-b-c)kJ?mol-1;
(3)根据某反应的平衡常数K=
| C2(NO2) |
| C(N2)C2(O2) |
故答案为:N2(g)+2O2(g)=2NO2(g)△H=+68kJ/mol;
(4)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H1=-890.3kJ/mol;
②C(石墨,s)+O2(g)=CO2(g);△H2=-393.5kJ/mol
③H2(g)+
| 1 |
| 2 |
)+2×(-285.8kJ/moL)-(-890.3kJ/mol)=-74.8kJ/mol,即C(石墨,s)+2H2(g)=CH4(g)△H=-74.8kJ/mol,
故答案为:C(石墨,s)+2H2(g)=CH4(g)△H=-74.8kJ/mol.
点评:本题考查了热化学方程式书写方法,注意反应聚集状态和对应反应焓变的计算,掌握基础是关键,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列离子方程式书写正确的是( )
| A、食醋除水垢中的碳酸钙 CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑ | ||
| B、等体积、等浓度的Ca(HCO3)2溶液和NaOH溶液混合Ca2++2HCO3-+2OH-=2H2O+CaCO3↓+CO32- | ||
| C、将磁性氧化铁溶于盐酸:Fe3O4+8H+=Fe3++4H2O | ||
D、向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-
|
 如图为实验室制取蒸馏水的装置示意图,回答下列问题:
如图为实验室制取蒸馏水的装置示意图,回答下列问题: 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液,在如右图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液,在如右图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: