题目内容
在0.5L溶有0.05mol/L NaCl和0.05mol/L CuCl2的溶液中,Cl-的物质的量浓度为( )
| A、0.05mol/L | B、0.1mol/L | C、0.15mol/L | D、0.3mol/L |
分析:0.5L溶有0.05mol/L NaCl和0.05mol/L CuCl2的溶液中,含有氯离子的物质的量为:0.05mol/L×0.5L+0.05mol/L×2×0.5L=0.025mol+0.05mol=0.075nol,再根据物质的量浓度c=
计算出溶液中氯离子的物质的量浓度即可.
| n |
| V |
解答:解:溶液中含有氯离子的物质的量为:0.05mol/L×0.5L+0.05mol/L×2×0.5L=0.025mol+0.05mol=0.075mol,
该溶液中氯离子的物质的量浓度为:c(Cl-)=
=0.15mol/L,
故选C.
该溶液中氯离子的物质的量浓度为:c(Cl-)=
| 0.075mol |
| 0.5L |
故选C.
点评:本题考查了物质的量浓度的简单计算,题目难度不大,注意掌握物质的量的概念及表达式,明确混合溶液中离子的物质的量浓度的计算方法,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
相关题目
Ⅰ.氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
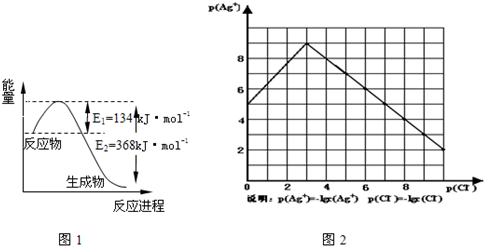
(1)图1是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和 CO反应的热化学方程式
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)?2NH3(g)△H<0,其化学平衡常数K与温度t的关系如表:请完成下列问题;
①试比较K1、K2的大小,K1 K2(填写“>”、“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据是 (填序号字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.υ(N2)(正)=3υ(H2)(逆)
c.容器内压强保持不变 d.混合气体的密度保持不变
③400℃时,反应2NH3(g)?N2(g)+3H2(g)的化学平衡常数的值为 .当测得NH3和N2、H2的物质的量分别为3mol和2mol、1mol时,则该反应的
υ(N2)(正) υ(N2)(逆) (填写“>”、“=”或“<”=)
Ⅱ.沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合
物的形成等都会使沉淀物的溶解度有所改变.已知AgCl+Cl-═[AgCl2]-,图2是某温度下AgCl在NaCl溶液中的溶解情况.
由以上信息可知:
(1)由图知该温度下AgCl的溶度积常数为 .
(2)AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:
(3)设计实验证明S(AgCl)>S(AgI)>S(Ag2S),实验方案是 .
(4)若在AgCl形成的浊液中滴加氨水有什么现象? .发生反应的离子方程式为 .

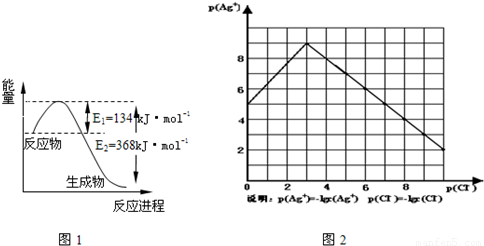
(1)图1是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和 CO反应的热化学方程式
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1、K2的大小,K1 K2(填写“>”、“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据是 (填序号字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.υ(N2)(正)=3υ(H2)(逆)
c.容器内压强保持不变 d.混合气体的密度保持不变
③400℃时,反应2NH3(g)?N2(g)+3H2(g)的化学平衡常数的值为 .当测得NH3和N2、H2的物质的量分别为3mol和2mol、1mol时,则该反应的
υ(N2)(正) υ(N2)(逆) (填写“>”、“=”或“<”=)
Ⅱ.沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合
物的形成等都会使沉淀物的溶解度有所改变.已知AgCl+Cl-═[AgCl2]-,图2是某温度下AgCl在NaCl溶液中的溶解情况.
由以上信息可知:
(1)由图知该温度下AgCl的溶度积常数为 .
(2)AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:
(3)设计实验证明S(AgCl)>S(AgI)>S(Ag2S),实验方案是 .
(4)若在AgCl形成的浊液中滴加氨水有什么现象? .发生反应的离子方程式为 .
Ⅰ.氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
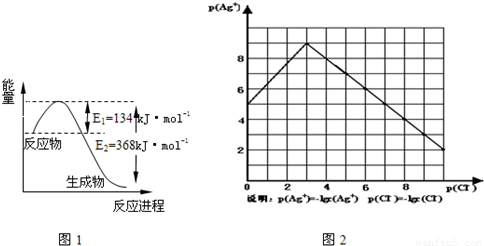
(1)图1是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和 CO反应的热化学方程式
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)?2NH3(g)△H<0,其化学平衡常数K与温度t的关系如表:请完成下列问题;
①试比较K1、K2的大小,K1 K2(填写“>”、“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据是 (填序号字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.υ(N2)(正)=3υ(H2)(逆)
c.容器内压强保持不变 d.混合气体的密度保持不变
③400℃时,反应2NH3(g)?N2(g)+3H2(g)的化学平衡常数的值为 .当测得NH3和N2、H2的物质的量分别为3mol和2mol、1mol时,则该反应的
υ(N2)(正) υ(N2)(逆) (填写“>”、“=”或“<”=)
Ⅱ.沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合
物的形成等都会使沉淀物的溶解度有所改变.已知AgCl+Cl-═[AgCl2]-,图2是某温度下AgCl在NaCl溶液中的溶解情况.
由以上信息可知:
(1)由图知该温度下AgCl的溶度积常数为 .
(2)AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:
(3)设计实验证明S(AgCl)>S(AgI)>S(Ag2S),实验方案是 .
(4)若在AgCl形成的浊液中滴加氨水有什么现象? .发生反应的离子方程式为 .

(1)图1是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和 CO反应的热化学方程式
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1、K2的大小,K1 K2(填写“>”、“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据是 (填序号字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.υ(N2)(正)=3υ(H2)(逆)
c.容器内压强保持不变 d.混合气体的密度保持不变
③400℃时,反应2NH3(g)?N2(g)+3H2(g)的化学平衡常数的值为 .当测得NH3和N2、H2的物质的量分别为3mol和2mol、1mol时,则该反应的
υ(N2)(正) υ(N2)(逆) (填写“>”、“=”或“<”=)
Ⅱ.沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合
物的形成等都会使沉淀物的溶解度有所改变.已知AgCl+Cl-═[AgCl2]-,图2是某温度下AgCl在NaCl溶液中的溶解情况.
由以上信息可知:
(1)由图知该温度下AgCl的溶度积常数为 .
(2)AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:
(3)设计实验证明S(AgCl)>S(AgI)>S(Ag2S),实验方案是 .
(4)若在AgCl形成的浊液中滴加氨水有什么现象? .发生反应的离子方程式为 .