题目内容
18.常温下,0.1mol/L的三种盐溶液NaX、NaY、NaZ的pH分别为7、8、9,则下列说法正确的是( )| A. | HX是弱酸 | B. | 离子浓度:c(Z-)>c(Y-)>c(X-) | ||
| C. | 电离常数:K(HZ)>K(HY) | D. | c(X-)=c(Y-)+c(HY)=c(Z-)+c(HZ) |
分析 常温下,0.1mol/L的三种盐溶液NaX、NaY、NaZ的pH分别为7、8、9,可知NaX是强酸强碱盐,NaY、NaZ均为弱酸弱碱盐,且根据“越弱越水解”可知,由于NaY溶液的碱性弱于NaZ,故HY的酸性强于HZ,即可知酸性强弱为HX>HY>HZ.据此分析.
解答 解:常温下,0.1mol/L的三种盐溶液NaX、NaY、NaZ的pH分别为7、8、9,可知NaX是强酸强碱盐,NaY、NaZ均为弱酸弱碱盐,且根据“越弱越水解”可知,由于NaY溶液的碱性弱于NaZ,故HY的酸性强于HZ,即可知酸性强弱为HX>HY>HZ.
A、0.1mol/L的NaX溶液pH=7,溶液显中性,故为强酸强碱盐,则HX为强酸,故A错误;
B、由于酸性强弱为HX>HY>HZ,而酸越弱,则对应的酸根离子越水解,故浓度均为0.1mol/L的三种盐溶液NaX、NaY、NaZ中,离子浓度:c(Z-)<c(Y-)<c(X-),故B错误;
C、由于HY和HZ均为一元弱酸,且酸性HY>HZ,而酸性越强,电离平衡常数越大,故电离常数:K(HY)>K(HZ),故C错误;
D、由于HX为强酸,故X-不水解,在NaX中,c(X-)=0.1mol/L;而HY和HZ均为弱酸,故在NaY和NaZ中,Y-和Z-均水解,根据物料守恒可知:c(Y-)+c(HY)=c(Z-)+c(HZ)=0.1mol/L,故有:c(Y-)+c(HY)=c(Z-)+c(HZ)=c(X-)=0.1mol/L,故D正确.
故选D.
点评 本题考查盐类的水解,题目难度中等,注意酸根离子水解程度越大,对应的酸越弱.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
8.下列说法正确的是( )
| A. | pH在5.6~7.0之间的降水通常称为酸雨 | |
| B. | 新制氯水经光照一段时间pH增大 | |
| C. | 燃煤时加入适量生石灰,可减少废气中SO2的量 | |
| D. | 测定某溶液pH应先用蒸馏水润湿pH试纸 |
9.已知40g A物质和28g B物质恰好完全反应生成17.6g C、7.2g D和0.4mol E,则E物质的摩尔质量是( )
| A. | 55 g•mol-1 | B. | 96 g•mol-1 | C. | 108 g•mol-1 | D. | 110 g•mol-1 |
3.关于下列装置说法正确的是( )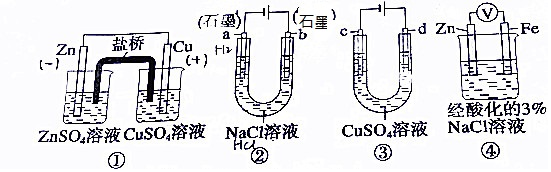

| A. | 装置①中,盐桥中的K+移向ZnSO4溶液 | |
| B. | 装置②工作一段后,a极附近的溶液pH增大,滴加酚酞为红色 | |
| C. | 用装置③精炼铜时,c极为粗铜 | |
| D. | 装置④中电子由Zn流向Fe,加入K3[Fe(CN)6]溶液产生蓝色沉淀 |
18.氧化还原反应是一类重要的化学反应,广泛存在于自然界中,对人们的生产、生活有着十分重要的作用.你认为下列对氧化还原反应的描述不正确的是( )
| A. | 肯定有电子得失 | |
| B. | 肯定是有关氧元素的反应 | |
| C. | 肯定有化合价的变化 | |
| D. | 氧化剂得到电子总数与还原剂失去电子总数相等 |
19.下列属于化学变化的是( )
| A. | 干冰升华 | B. | 氯气液化 | C. | 海水晒盐 | D. | 钢铁生锈 |



