题目内容
10.两种金属的混合物共15g,跟足量的盐酸反应时,恰好得到11.2L氢气(标况).下列各组金属不可能构成上述条件的混合物的是( )| A. | 镁和银 | B. | 铁和锌 | C. | 铝和铁 | D. | 镁和铁 |
分析 假设金属都为+2价,金属总物质的量等于氢气物质的量,根据M=$\frac{m}{n}$计算金属混合物的平均相对原子质量,故平均相对原子质量应介于各组分之间,根据电子转移守恒,若金属不与盐酸反应,其相对原子质量可以视作无穷大,若Al为+2价时,其相对原子质量为27×$\frac{2}{3}$=18.
解答 解:标况下11.2L氢气物质的量为:$\frac{11.2L}{22.4L/mol}$=0.5mol,假设金属均为+2价,金属总物质的量等于氢气物质的量,故混合金属平均相对分子质量为$\frac{15}{0.5}$=30,因为为两种金属的混合物,故平均相对分子质量应介于各组分之间.
A.Mg的相对原子质量为24,Ag与盐酸不反应,其相对原子质量视作无穷大,符合题意,故A正确;
B.Fe的相对原子质量为56,Zn的相对分子质量为65,平均值大于30,不符合题意,故B错误;
C.若Al为+2价时,其相对原子质量为27×$\frac{2}{3}$=18,Fe的相对原子质量为56,符合题意,故C正确;
D.Mg的相对原子质量为24,Fe的相对原子质量为56,平均值可能为30,故D正确;
故选B.
点评 本题考查混合物的计算,难度中等,注意利用平均值法析解答,侧重考查学生分析计算能力,注意化合价与相对原子质量的关系.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
6.下列离子检验的操作或说法正确的是( )
| A. | 某溶液加入几滴KSCN溶液后不变色再滴加几滴氯水后,溶液变红,说明该溶液一定有Fe2+ | |
| B. | 某溶液滴加AgNO3溶液产生白色沉淀,说明该溶液一定含Cl- | |
| C. | 某溶液加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中,溶液变浑浊,说明该溶液一定有CO32- | |
| D. | 某溶液滴加盐酸酸化的BaCl2溶液后,有白色沉淀产生,说明该溶液一定含SO42- |
5.常温下,pH>7的某溶液中只含有Na+、CH3COO-、H+、OH-四种离子,下列描述正确的是( )
| A. | 该溶液只能由等物质的量浓度、等体积的氢氧化钠溶液和醋酸溶液混合而成 | |
| B. | 该溶液一定由pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合而成 | |
| C. | 该溶液中离子浓度一定为c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 加入一定冰醋酸,c(CH3COO-)可能大于、等于或小于c(Na+) |
2.直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:SO2+H2O?H2SO3;2H2SO3+O2=2H2SO4.
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是2OH-+SO2=SO32-+H2O.
(3)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表所示:
①由上表判断,NaHSO3溶液显酸性,用化学平衡原理解释HSO3-存在HSO3-?H++SO32-和HSO3-+H2O?H2SO3+OH-,HSO3-的电离程度大于水解程度.
②当吸收液呈中性时,下列溶液中离子浓度关系正确的是(选填字母)ab.
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生.再生示意图如下:
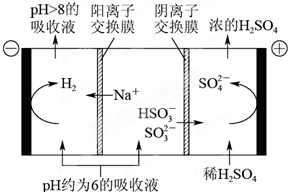
①HSO3-在阳极放电的电极反应式是HSO3-+H2O-2e-=SO42-+3H+.
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用.简述再生原理氢离子在阴极得电子生成氢气,溶液中OH-浓度增大,溶液中氢离子浓度降低,促使HSO3-电离生成SO32-,且钠离子进入阴极室,吸收液就可以再生.
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:SO2+H2O?H2SO3;2H2SO3+O2=2H2SO4.
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是2OH-+SO2=SO32-+H2O.
(3)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表所示:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
②当吸收液呈中性时,下列溶液中离子浓度关系正确的是(选填字母)ab.
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生.再生示意图如下:

①HSO3-在阳极放电的电极反应式是HSO3-+H2O-2e-=SO42-+3H+.
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用.简述再生原理氢离子在阴极得电子生成氢气,溶液中OH-浓度增大,溶液中氢离子浓度降低,促使HSO3-电离生成SO32-,且钠离子进入阴极室,吸收液就可以再生.
19.已知:相同的两种元素组成的四种微粒A、B、C、D的质子数依次增多,A、B、C、D的电子数如表(A、B、C、D有两组可能),且D中的电子数等于质子数,D1可作医用消毒液. 其中B1的沸点比B2高.
试回答下列问题:
(1)如表两组八种微粒的组成元素中,非金属性最强的元素在元素周期表的位置是第二周期第VI族;
(2)液态的B2与Na反应类似于B1与Na反应,写出液态的B2与Na反应的化学方程式:2Na+2NH3(l)=2NaNH2+H2↑.
(3)①亚氯酸钠(NaClO2)主要可用于棉纺、造纸业做漂白剂,也用于食品消毒、水处理等,制备亚氯酸钠,可以将ClO2气体通入D1和NaOH的混合液中,请写出制备化学反应方程式2ClO2+2NaOH+H2O2=2NaClO2+2H2O+O2,其中D1的作用是还原剂.
②利用①中原理制备出NaClO2•3H2O晶体的试样,可以用“间接碘量法”测定试样(不含能与Iˉ发生反应的氧化性杂质)的纯度,过程如图(已知:I2+2S2O32ˉ═S4O62ˉ+2Iˉ):
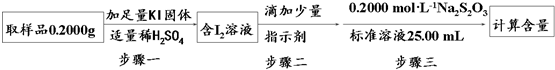
步骤一的离子方程式为ClO2-+4I-+4H+=2I2+Cl-+2H2O;步骤二的指示剂是淀粉;步骤三中出现溶液由蓝色变无色,且半分钟不变色现象时,达到滴定终点;计算该试样中NaClO2•3H2O的质量百分数为90.3%.(保留小数点后一位)
| ① | A1 | B1 | C1 | D1 |
| 电子数 | 10 | 10 | 10 | 18 |
| ② | A2 | B2 | C2 | D2 |
| 电子数 | 10 | 10 | 10 | 18 |
(1)如表两组八种微粒的组成元素中,非金属性最强的元素在元素周期表的位置是第二周期第VI族;
(2)液态的B2与Na反应类似于B1与Na反应,写出液态的B2与Na反应的化学方程式:2Na+2NH3(l)=2NaNH2+H2↑.
(3)①亚氯酸钠(NaClO2)主要可用于棉纺、造纸业做漂白剂,也用于食品消毒、水处理等,制备亚氯酸钠,可以将ClO2气体通入D1和NaOH的混合液中,请写出制备化学反应方程式2ClO2+2NaOH+H2O2=2NaClO2+2H2O+O2,其中D1的作用是还原剂.
②利用①中原理制备出NaClO2•3H2O晶体的试样,可以用“间接碘量法”测定试样(不含能与Iˉ发生反应的氧化性杂质)的纯度,过程如图(已知:I2+2S2O32ˉ═S4O62ˉ+2Iˉ):

步骤一的离子方程式为ClO2-+4I-+4H+=2I2+Cl-+2H2O;步骤二的指示剂是淀粉;步骤三中出现溶液由蓝色变无色,且半分钟不变色现象时,达到滴定终点;计算该试样中NaClO2•3H2O的质量百分数为90.3%.(保留小数点后一位)
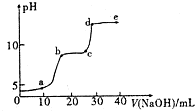 某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.
某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.
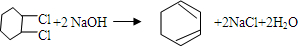 、⑤
、⑤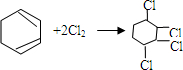 .
.