题目内容
11.下列说法正确的是( )| A. | CO2的水溶液能导电,所以CO2是电解质 | |
| B. | 氧化剂在反应中得到的电子越多,氧化能力越强 | |
| C. | 分散质粒子大小为几纳米到几百十纳米的分散系是胶体 | |
| D. | Cl2的氧化性比I2强,而I-的还原性却比Cl-强 |
分析 A.电解质:在水溶液中或熔融状态下能导电的化合物;例:酸、碱、盐,金属氧化物等;
B.氧化剂在反应中越易得电子,氧化能力越强;
C.分散质粒子大小为1-100纳米的分散系是胶体;
D.根据“易得不易失”分析.
解答 解:A.二氧化碳本身不能电离,其溶于水能导电的原因是二氧化碳与水反应生成了碳酸,碳酸导电,二氧化碳属于非电解质,故A错误;
B.氧化性的强弱与得电子多少无关,氧化剂在反应中越易得电子,氧化能力越强,故B错误;
C.分散质粒子大小为1-100纳米的分散系是胶体,则分散质粒子大小为几纳米到几十纳米的分散系是胶体,故C错误;
D.氧化性:Cl2>I2,说明Cl2比I2易得电子,则Cl-相对于I-不易失电子,即为还原性:Cl-<I-,故D正确;
故选D.
点评 本题考查问题较为全面,涉及电解质和非电解质的区分、氧化性和还原性的比较、物质分离和提纯等知识,为高频考点,难度不大,注意氧化还原反应理论的学习.

练习册系列答案
相关题目
19.下列指定反应的离子方程式正确的是( )
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 澄清的石灰水与稀盐酸反应 Ca (OH)2+2H+═Ca2++2H2O | |
| C. | 酸性溶液中KIO3与KI反应生成I2:IO3-+I-+6H+═I2+3H2O | |
| D. | NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O |
3.下列各组离子一定能大量共存的是( )
| A. | 在无色溶液中:Na+、Fe2+、Cl-、SO42- | |
| B. | 在酸性溶液中:NH4+、Ca2+、NO3-、HCO3- | |
| C. | 在碱性溶液中:K+、Ba2+、SO42-、NO3- | |
| D. | 在含大量Mg2+的溶液中:Na+、NH4+、SO42-、Cl- |
1.下列溶液中粒子的物质的量浓度关系正确的是( )
| A. | 0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| B. | 20mL 0.1mol/L CH3COONa溶液与10mL 0.1mol/L HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-) | |
| D. | 0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
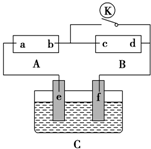 如图所示,A为直流电源,B为浸透饱和硫酸钠溶液和紫色石蕊溶液的滤纸,C为电镀池,接通电路后,发现B上的c点显蓝色,请填空:
如图所示,A为直流电源,B为浸透饱和硫酸钠溶液和紫色石蕊溶液的滤纸,C为电镀池,接通电路后,发现B上的c点显蓝色,请填空: