题目内容
19.下表列出了前20号元素中的某些元素性质的有关数据:| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径 (10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | -- | +3 | +4 | +5 | +7 | +1 | +5 | -- |
| 最低价态 | -- | -- | -2 | -- | -4 | -3 | -1 | -- | -3 | -1 |
(1)以上10种元素的原子中,最容易失去电子的是②(填写编号);与H2最容易化合的非金属单质是氟气(写物质名称).
(2)写出元素⑤的氢化物结构式
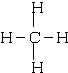 ;③和⑤形成的化合物的电子式
;③和⑤形成的化合物的电子式 ;写出元素③和⑧形成的既有离子键,又有共价键的化合物的电子式
;写出元素③和⑧形成的既有离子键,又有共价键的化合物的电子式 ;
;(3)某元素R的原子半径为1.02×10-10m,该元素在周期表中的位置第三周期第VIA族.
(4)写出上述⑥、⑦两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的一种物质的分子式PCl3.
(5)试比较⑤和⑨两元素的最高价氧化物对应的水化物的酸性强弱(填化学式):HClO4>HNO3
(6)写出④的最高价氧化物分别跟⑦和⑧的最高价氧化物的水化物反应的离子方程式OH-+Al(OH)3=AlO2-+2H2O,Al(OH)3+3H+=Al3++3H2O.
分析 ①②⑧最高正价为+1,为第IA族元素,原子半径都大于⑩原子半径,结合原子半径可知,①是Li元素、②是K元素、⑧是Na元素;
⑦⑩最低价为-1,为第VIIA族元素,⑦的原子半径大于⑩,所以⑦是Cl元素、⑩是F元素;
③只有-2价,没有正化合价,为第VIA族元素,则③是O元素;
④只有+3价,为第IIIA族元素,原子半径大于Cl原子半径,所以④是Al元素;
⑤有+4、-4价,为第IVA族元素,原子半径小于Cl原子半径,所以⑤是C元素;
⑥⑨有+5、-3价,为第VA族元素,⑥的原子半径大于⑨,则⑥是P元素、⑨是N元素;
结合物质的性质分析解答即可.
解答 解:①②⑧最高正价为+1,为第IA族元素,原子半径都大于⑩原子半径,结合原子半径可知,①是Li元素、②是K元素、⑧是Na元素;
⑦⑩最低价为-1,为第VIIA族元素,⑦的原子半径大于⑩,所以⑦是Cl元素、⑩是F元素;
③只有-2价,没有正化合价,为第VIA族元素,则③是O元素;
④只有+3价,为第IIIA族元素,原子半径大于Cl原子半径,所以④是Al元素;
⑤有+4、-4价,为第IVA族元素,原子半径小于Cl原子半径,所以⑤是C元素;
⑥⑨有+5、-3价,为第VA族元素,⑥的原子半径大于⑨,则⑥是P元素、⑨是N元素,
(1)电子层数越多,最外层电子数越少,受原子核的吸引力越小,越容易失去最外层电子,在这些元素中K电子层数最多,最外层电子数最少为1,元素的非金属性越强,与氢气化合越容易,F的非金属性最强,故答案为:②;氟气;
(2)C元素形成点的氢化物为甲烷,甲烷为正四面体结构,其结构式为: ,CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子,其电子式为
,CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子,其电子式为 ,Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,电子式为
,Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,电子式为 ,故答案为:
,故答案为: ;
; ;
; ;
;
(3)原子半径为1.02×10-10m大于Cl却小于P,故R应是S,处于第三周期第VIA族,故答案为:CCl4或PCl3;第三周期第VIA族;
(4)P与Cl形成的每个原子都满足最外层为8电子稳定结构的分子PCl3,故答案为:PCl3;
(5)高氯酸为强酸,硝酸也为强酸,元素的非金属性越强,其对应最高价氧化物的水化物的酸性越强,故酸性HClO4大于HNO3,故答案为:HClO4;HNO3;
(6)氢氧化铝为两性强氧化物,能与氢氧化钠反应生成偏铝酸钠和水,与高氯酸反应生成铝盐和水,离子反应方程式分别为:OH-+Al(OH)3=AlO2-+2H2O;Al(OH)3+3H+=Al3++3H2O,故答案为:OH-+Al(OH)3=AlO2-+2H2O;Al(OH)3+3H+=Al3++3H2O.
点评 本题考查较综合,涉及化学式的确定、电子式的书写、8电子稳定结构的判断、离子反应方程式等知识点,根据元素周期律判断元素是解本题关键,难度中等.

| A. | 所涉及元素的第一电离能:N>O>C | |
| B. | 当x=2时,每生成1molN2,转移电子数为4mol | |
| C. | 等物质的量N2和C02中,π键的个数比为1:1 | |
| D. | 氧化剂与还原剂的物质的量之比为1:1时,NOx中氮元素的化合价为+2价 |
| A. | 7种 | B. | 8种 | C. | 9种 | D. | 11种 |
| A. | SiO2是酸性氧化物,能与溶液反应 | |
| B. | Na2CO3和NaHCO3都是盐,都能与CaCl2溶液反应 | |
| C. | CO和NO都是大气污染物,在空气中都能稳定存在 | |
| D. | Al在浓盐酸中会“钝化”,能用铝槽盛放浓盐酸 |
 )涂在手术后的伤口上,数秒钟内可发生加聚反应而固化,是一种固化迅速的医用高分子缝合材料.这种化合物是由三种单体合成的.试回答:
)涂在手术后的伤口上,数秒钟内可发生加聚反应而固化,是一种固化迅速的医用高分子缝合材料.这种化合物是由三种单体合成的.试回答: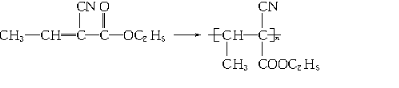 .
. 的系统命名为:2,4-二甲基-3-乙基己烷.
的系统命名为:2,4-二甲基-3-乙基己烷. <
< (填“>”“<”或“=”,下同)
(填“>”“<”或“=”,下同)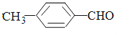 <
<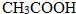 (提示:类比酚与醇的酸性)
(提示:类比酚与醇的酸性)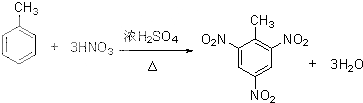 ;
; )在催化剂条件下,合成聚乳酸(PLA)的反应方程式:
)在催化剂条件下,合成聚乳酸(PLA)的反应方程式: .
. 如图为实验室制氢气的简单装置.若在加稀硫酸时,发现锌粒与稀硫酸没有接触而稀硫酸又不够了,为使该反应顺利进行,则可以从长颈漏斗中加入的试剂是( )
如图为实验室制氢气的简单装置.若在加稀硫酸时,发现锌粒与稀硫酸没有接触而稀硫酸又不够了,为使该反应顺利进行,则可以从长颈漏斗中加入的试剂是( )