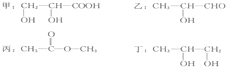题目内容
下列离子方程式正确的是( )
| A、澄清的石灰水与盐酸反应:Ca(OH)2+2H+=Ca2++2H2O | ||||
| B、钠与水的反应:Na+2H2O=Na++2OH-+H2↑ | ||||
C、Ca(HCO3)2与过量Ca(OH)2溶液反应:Ca2++HCO
| ||||
| D、大理石溶于醋酸的反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A.澄清石灰水中,氢氧化钙在离子方程式中应该拆开,不能保留化学式;
B.根据电荷守恒判断,该离子方程式两边电荷不守恒;
C.氢氧化钙过量,离子方程式按照碳酸氢钙的组成书写,反应后碳酸根离子完全转化成碳酸钙沉淀;
D.大理石为难溶物,醋酸为弱电解质,大理石和醋酸在离子方程式中都需要保留化学式.
B.根据电荷守恒判断,该离子方程式两边电荷不守恒;
C.氢氧化钙过量,离子方程式按照碳酸氢钙的组成书写,反应后碳酸根离子完全转化成碳酸钙沉淀;
D.大理石为难溶物,醋酸为弱电解质,大理石和醋酸在离子方程式中都需要保留化学式.
解答:
解:A.澄清的石灰水与盐酸反应生成氯化钙和水,氢氧化钙应该拆开,正确的离子方程式为:OH-+H+=2H2O,故A错误;
B.钠与水反应生成氢氧化钠和氢气,离子方程式两边必须满足电荷守恒,正确的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,故B错误;
C.Ca(HCO3)2与过量Ca(OH)2溶液反应生成碳酸钙和水,反应的离子方程式为:Ca2++HCO3-+OH-=CaCO3↓+H2O,故C错误;
D.大理石的主要成分为碳酸钙,碳酸钙溶于醋酸生成醋酸钙、二氧化碳和水,反应的离子方程式为:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O,故D正确;
故选D.
B.钠与水反应生成氢氧化钠和氢气,离子方程式两边必须满足电荷守恒,正确的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,故B错误;
C.Ca(HCO3)2与过量Ca(OH)2溶液反应生成碳酸钙和水,反应的离子方程式为:Ca2++HCO3-+OH-=CaCO3↓+H2O,故C错误;
D.大理石的主要成分为碳酸钙,碳酸钙溶于醋酸生成醋酸钙、二氧化碳和水,反应的离子方程式为:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O,故D正确;
故选D.
点评:本题考查了离子方程式的正误判断,为高考中的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列叙述中不正确的是( )
| A、除去FeCl2溶液中的FeCl3杂质,可以向溶液中加入过量铁粉,然后过滤 |
| B、Na2O2用于呼吸面具,活性炭用于防毒面具,两者原理不同 |
| C、NaOH、Na2CO3、NaHCO3的溶液均呈碱性,所以可以共存 |
| D、62g Na2O和78g Na2O2分别溶于等量且足量的水中,所得溶液中溶质的质量分数相等 |
据报道,某地市的化工总厂相继发生氯气泄漏和爆炸事故,在事故中多人伤亡,15万人被紧急疏散.当人们逃离时,不能采用的方法是( )
| A、躲到低洼的地方 |
| B、向较高的地方逃离 |
| C、用肥皂水浸湿毛巾捂住鼻子逃离 |
| D、用水浸湿毛巾捂住鼻子逃离 |
下列物质不属于电解质,但其水溶液能导电的是( )
| A、HCl |
| B、BaCO3 |
| C、NaCl |
| D、CO2 |
25℃时,用0.1mol/L的醋酸溶液做了以下实验,不能证明其为弱酸的是( )
| A、pH大于1 |
| B、溶液中含有HAc分子 |
| C、溶液中含有OH- |
| D、导电能力比0.1mol/L的盐酸弱 |
下列关于有机物的说法错误的是( )
| A、丙烷比丁烷更难液化 |
| B、碳氢化合物中一定存在极性键 |
| C、有5个碳原子的有机物,可形成含5个C-C单键的分子 |
| D、乙炔是含碳量最高的碳氢化合物 |