题目内容
下列元素的原子在形成不同物质时,既能形成离子键,又能形成共价键的是( )
| A、K | B、Ca | C、Cl | D、Ne |
考点:离子化合物的结构特征与性质,共价键的形成及共价键的主要类型
专题:化学键与晶体结构
分析:一般来说,活泼金属与活泼非金属形成离子键,活泼非金属之间形成共价键,以此来解答.
解答:
解:K、Ca为活泼金属,只能失去电子形成离子键,而Ne一般不能形成化学键,只有Cl可得到电子或与其它原子共用电子,如NaCl中为离子键,HCl中为共价键,
故选C.
故选C.
点评:本题考查化学键,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,注意金属只能失去电子,注重基础知识的考查,题目难度不大.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
下列对有机物结构或性质的描述,错误的是( )
| A、一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 |
| B、苯和乙烯,只有乙烯能与H2发生加成反应 |
| C、乙烷和丙烯的物质的量共1 mol,完全燃烧生成3 mol H2O |
| D、光照下2,2-二甲基丙烷与Br2反应,其一溴取代物只有一种 |
 如图所示的装置,C、D、E、F都是惰性电极.将电源接通后,向1mol/L的MgCl2溶液中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )
如图所示的装置,C、D、E、F都是惰性电极.将电源接通后,向1mol/L的MgCl2溶液中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )| A、电源A极是负极 |
| B、左烧杯内溶液的pH减小,右烧杯有白色浑浊出现 |
| C、电极D是阳极,发生的电极反应为:4OH-+4e-═2H2O+O2 |
| D、C﹑D﹑E﹑F电极均有单质生成,其物质的量之比为2:1:1:1 |
在2升的密闭容器中,反应物的物质的量为3mol,经过20s后,它的物质的量变成了1mol,在这20s内它的反应速率为( )
| A、0.1 mol/(L?S) |
| B、0.05mol/( L?min) |
| C、0.05mol/(L?s) |
| D、0.8mol/(L?S) |
下列物质中,用乙烯作原料通过一步反应不能得到的是( )
| A、CH3CH2Cl |
| B、CH2=CHCl |
| C、CH3CH2OH |
| D、CH2Br-CH2Br |
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A、常温常压下,2.8g N2与C2H4的混合气体所含电子数为1.4 NA |
| B、标准状况下,1.12 L NO与1.12O2的混合物中含有的原子数为0.2NA |
| C、25℃时,pH=13的 Ba(OH)2溶液中含有的OH-数目为0.1 NA |
| D、常温下,1 L 0.1 mol?L-1的NH4NO3溶液中氧原子数为0.3 NA |
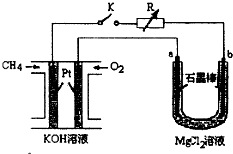 新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入 CH4和 O2,电解质为 KOH 溶液.某研究小组将甲烷燃料电 池作为电源进行氯化镁溶液龟解实验,电解装置如图所示.
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入 CH4和 O2,电解质为 KOH 溶液.某研究小组将甲烷燃料电 池作为电源进行氯化镁溶液龟解实验,电解装置如图所示.