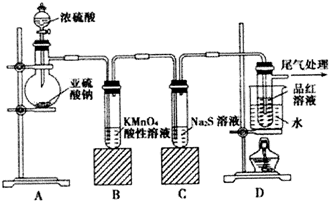
题目内容
14.在xR2++yH++O2=mR3++nH2O的离子方程式中,对化学计量数m 和R2+、R3+ 判断正确的是( )| A. | m=y,H2O 是还原产物 | B. | n=2m,R2+ 是还原剂 | ||
| C. | m=4,O2发生氧化反应 | D. | m=2y,R2+ 被氧化 |
分析 根据氧原子守恒,所以n=2,根据氢原子守恒,所以y=4,根据R原子守恒则x=m,根据电荷守恒则2x+y=3m,所以x=y=m,在反应中,R的化合价升高,R2+是还原剂,所以R3+是氧化产物,氧元素化合价降低,所以H2O是还原产物,以此来解答.
解答 解:根据氧原子守恒,所以n=2,根据氢原子守恒,所以y=4,根据R原子守恒则x=m,根据电荷守恒则2x+y=3m,所以x=y=m,在反应中,R的化合价升高,R2+是还原剂,所以R3+是氧化产物,氧元素化合价降低,所以H2O是还原产物,
A、m=y,H2O是还原产物,故A正确;
B、n=2,m=4,2n=m,R2+是还原剂,故B错误;
C、m=4,O2是氧化剂,发生还原反应,故C错误;
D、x=y=m,R2+是还原剂,被氧化,故D错误;
故选:A.
点评 本题考查氧化还原反应,明确反应中元素的化合价变化即可解答,注意原子守恒、电荷守恒的应用为解答的关键,题目难度中等.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
1.下列物质的检验,其结论一定正确的是( )
| A. | 向某溶液中加入BaCl2溶液,产生白色沉淀,加入HNO3后,白色沉淀不溶解,也无其他现象,说明原溶液中一定含有SO42- | |
| B. | 向某溶液中加盐酸产生无色气体,该气体能使澄清的石灰水变浑浊,说明该溶液中一定含有CO32-或SO32- | |
| C. | 取少量久置的Na2SO3样品于试管中加水溶解,再加盐酸酸化,然后加BaCl2溶液,若加盐酸有气体产生,加BaCl2有白色沉淀产生,说明Na2SO3样品已部分被氧化 | |
| D. | 将某气体通入品红溶液中,品红溶液褪色,该气体一定是SO2 |
5.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 1 mol N2所含有的原子数为NA | |
| B. | 标准状况下,22.4 L水中含有的水分子数为NA | |
| C. | 24 g O2分子和24 g O3分子所含的氧原子数目相等 | |
| D. | 1mol•L-1的盐酸中氯离子为NA |
9.工业上利用NaOH溶液来吸收、分离并利用CO2,其基本过程如下图所示(部分条件及物质未标出):
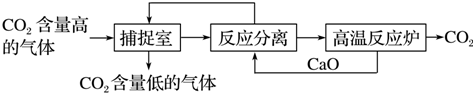
下列有关该方法的叙述中不正确的是( )

下列有关该方法的叙述中不正确的是( )
| A. | 生产过程中,可循环利用的物质有CaO和NaOH | |
| B. | 该方法涉及了化合、分解和复分解等反应类型 | |
| C. | 该方法通过化学变化,分离、提纯并利用CO2,可以减少碳的排放 | |
| D. | “反应分离”环节中,分离物质的基本操作是蒸发、结晶 |
19.几位同学想用实验的方法,通过自己的亲自观察证明这样一个事实:氯气通入水中能发生反应,但没有全部转化为HClO和HCl.你认为下列相关说法正确的是( )
| A. | 向新制的氯水中加KI?淀粉溶液即可证明 | |
| B. | 向久置失效的氯水中加KI?淀粉溶液即可证明 | |
| C. | 直接观察氯水溶液仍显黄绿色即可说明,不需进一步实验 | |
| D. | 用实验证明干燥的氯气不能使干燥的有色布条褪色,能使湿润的有色布条褪色 |
6.下列有关有机反应类型的判断错误的是( )
| A. | CH2═CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH 加成反应 | |
| B. | 2CH3CH2OH $?_{140℃}^{浓硫酸}$CH3CH2OCH2CH3+H2O 消去反应 | |
| C. |  $?_{△}^{浓硫酸}$ $?_{△}^{浓硫酸}$  +H2O取代反应 +H2O取代反应 | |
| D. |  加聚反应 加聚反应 |
4.在强酸性溶液中能大量共存,并且溶液透明的是( )
| A. | K+、Ca2+、HCO3-、Cl- | B. | Cu2+、Na+、NO3-、Cl- | ||
| C. | Na+、Fe3+、SO42-、CO32- | D. | Mg2+、NH4+、Cl-、OH- |
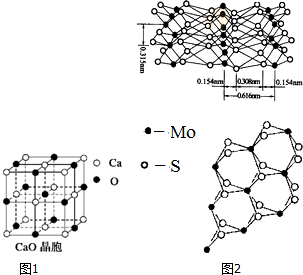 决定物质性质的重要因素是物质结构.请回答下列问题.
决定物质性质的重要因素是物质结构.请回答下列问题.