题目内容
10.1mol下列物质中共用电子对数目最少是( )| A. | N2 | B. | 金刚石 | C. | HCN | D. | CO2 |
分析 根据各物质分子的电子数判断共用电子对数目多少,来分析解答.
解答 解:A、氮气分子的电子式为: ,所以电子对数为3,所以1mol氮气中含3mol的共用电子对;
,所以电子对数为3,所以1mol氮气中含3mol的共用电子对;
B、金刚石晶体中一个碳与四个碳原子形成空间网状结构,所以1mol金刚石中含有2mol的共用电子对;
C、1molHCN中含有4mol的共价键;
D、1mol二氧化碳中含有4mol的共价键;
综上所述1mol下列物质中共用电子对数目最少是金刚石,故选B.
点评 本题以判断共用电子对数多少为载体考查了分子的电子式,难度不大,根据分子的电子式即可解答本题.

练习册系列答案
相关题目
18. 实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
 实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )| 选项 | a分液漏斗中的物质 | b圆底烧瓶中的物质 | c集气瓶中收集的气体 | d烧杯中的物质 |
| A | 浓氨水 | CaO | NH3 | H2O |
| B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
| C | 稀硝酸 | Cu | NO2 | H2O |
| D | 稀盐酸 | MnO2 | Cl2 | NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
19.下列实验中,对应的现象以及结论均正确的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 向淀粉水解后的溶液中滴加银氨溶液 | 未见银镜产生 | 淀粉没有水解 |
| B | 混合分别装有Cl2和NH3的集气瓶中的气体 | 产生大量白烟 | NH3显还原性和碱性 |
| C | 向1.0mol•L-1的NaHA溶液中滴加2滴甲基橙 | 溶液呈黄色 | NaHA溶液显碱性 |
| D | 相同的锌片分别与同温同体积,且c(H+)=1mol•L-1的盐酸、硫酸反应 | 锌与盐酸反应产生气泡较快 | 一定是Cl-对该反应起到促进作用 |
| A. | A | B. | B | C. | C | D. | D |
16. 化学反应速率和限度与生产、生活密切相关.
化学反应速率和限度与生产、生活密切相关.
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如表(累计值):
①哪一时间段反应速率最大2~3min(填0~1、1~2、2~3、3~4、4~5),原因是因该反应是放热反应,此时温度高且盐酸浓度较大,所以反应速率较快.
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率0.025mol/(L•min)(设溶液体积不变).
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是CD.
A.蒸馏水 B.KCl溶液 C.KNO3溶液 D.CuSO4溶液
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图.
①该反应的化学方程式是3X+Y?2Z.
②该反应达到平衡状态的标志是CD
A.X、Y、Z的反应速率相等
B.X、Y的反应速率比为3:1
C.容器内气体压强保持不变
D.生成1mol Y的同时生成2mol Z
③2min内X的转化率为30%.
④若上述反应中X、Y、Z分别为H2、N2、NH3,且已知17g氨气分解成氮气和氢气要吸收46kJ热量,则该反应的热化学反应方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol.
 化学反应速率和限度与生产、生活密切相关.
化学反应速率和限度与生产、生活密切相关.(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如表(累计值):
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL)(标准状况) | 100 | 240 | 464 | 576 | 620 |
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率0.025mol/(L•min)(设溶液体积不变).
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是CD.
A.蒸馏水 B.KCl溶液 C.KNO3溶液 D.CuSO4溶液
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图.
①该反应的化学方程式是3X+Y?2Z.
②该反应达到平衡状态的标志是CD
A.X、Y、Z的反应速率相等
B.X、Y的反应速率比为3:1
C.容器内气体压强保持不变
D.生成1mol Y的同时生成2mol Z
③2min内X的转化率为30%.
④若上述反应中X、Y、Z分别为H2、N2、NH3,且已知17g氨气分解成氮气和氢气要吸收46kJ热量,则该反应的热化学反应方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol.
5.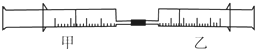 如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质推压到甲针筒内,进行表中所列的4个不同实验(气体体积在同温同压下测定).下列说法正确的是( )
如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质推压到甲针筒内,进行表中所列的4个不同实验(气体体积在同温同压下测定).下列说法正确的是( )
 如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质推压到甲针筒内,进行表中所列的4个不同实验(气体体积在同温同压下测定).下列说法正确的是( )
如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质推压到甲针筒内,进行表中所列的4个不同实验(气体体积在同温同压下测定).下列说法正确的是( )| 实验序号 | 甲针筒内物质 | 乙针筒内物质 |
| 1 | 10mL HCl | 10mL NH3 |
| 2 | 30mL NO2 | 10mL H2O(液) |
| 3 | 20mL HBr | 10mL Cl2 |
| 4 | 10mL CCl4 | 10mL NH3 |
| A. | 上述4个实验均发生了氧化还原反应 | |
| B. | 实验2,甲针筒内最终的无色气体是NO | |
| C. | 实验3,甲针筒内充满黄绿色气体 | |
| D. | 实验4,甲针筒内活塞将向右移动 |
15.NA代表阿伏加德罗常数.下列有关叙述正确的是( )
| A. | ${\;}_{92}^{235}U$是核电站的主要原料,2.35g${\;}_{92}^{235}U$的中子数为0.92NA | |
| B. | ${\;}_{53}^{131}I$具有放射性,1.31g${\;}_{53}^{131}I$具有的中子数为0.78NA | |
| C. | 标准状况下,11.2L氦气中约含有NA个氦原子 | |
| D. | 0.1mol•L-1Na2CO3溶液中含有0.1NA个CO32- |
19. 尿素是首个由无机物人工合成的有机物.工业上尿素由CO2和NH3在一定条件下合成,当氨碳比n(NH3)/n(CO2)=4,CO2的转化率随时间的变化关系如图所示,则A点的逆反应速率v逆(CO2)与B点的正反应速率v正(CO2)的大小关系为( )
尿素是首个由无机物人工合成的有机物.工业上尿素由CO2和NH3在一定条件下合成,当氨碳比n(NH3)/n(CO2)=4,CO2的转化率随时间的变化关系如图所示,则A点的逆反应速率v逆(CO2)与B点的正反应速率v正(CO2)的大小关系为( )
 尿素是首个由无机物人工合成的有机物.工业上尿素由CO2和NH3在一定条件下合成,当氨碳比n(NH3)/n(CO2)=4,CO2的转化率随时间的变化关系如图所示,则A点的逆反应速率v逆(CO2)与B点的正反应速率v正(CO2)的大小关系为( )
尿素是首个由无机物人工合成的有机物.工业上尿素由CO2和NH3在一定条件下合成,当氨碳比n(NH3)/n(CO2)=4,CO2的转化率随时间的变化关系如图所示,则A点的逆反应速率v逆(CO2)与B点的正反应速率v正(CO2)的大小关系为( )| A. | v逆(CO2)>v正(CO2) | B. | v逆(CO2)<v正(CO2) | C. | v逆(CO2)=v正(CO2) | D. | 无法判断 |
20.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 常温常压下,14 g丙烯和环丙烷混合气体中碳原子数为NA | |
| B. | 标准状况下,11.2 L乙烷含有共价键数为3NA | |
| C. | 密闭容器中充入1 mol I2(g)和2 mol H2(g)充分反应,生成HI分子数为2NA | |
| D. | Na2O2与CO2反应时,生成0.5 mol O2转移的电子数为2NA |