题目内容
1.7g氨气在标准状况下的体积是________升,共含有________mol电子;0.1mol硫化氢共含有________个质子,同质量的氨气和硫化氢气体中分子个数比为________,含氢原子的个数比为________.在标准状况下硫化氢的密度为________.
分析:氨气的摩尔质量为17g/mol,由n=
 、V=nVm计算体积,由物质的构成来计算电子数及质子数;硫化氢的摩尔质量为34g/mol,同质量的氨气和硫化氢的物质的量之比为2:1,物质的量之比等于分子数之比,由物质的构成计算原子个数比;再利用ρ=
、V=nVm计算体积,由物质的构成来计算电子数及质子数;硫化氢的摩尔质量为34g/mol,同质量的氨气和硫化氢的物质的量之比为2:1,物质的量之比等于分子数之比,由物质的构成计算原子个数比;再利用ρ= 计算标准状况下硫化氢的密度.
计算标准状况下硫化氢的密度.解答:氨气的摩尔质量为17g/mol,由n=
 =
=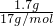 =0.1mol,则标况下V=nVm=0.1mol×22.4L/mol=2.24L,含有的电子为0.1mol×10=1mol;
=0.1mol,则标况下V=nVm=0.1mol×22.4L/mol=2.24L,含有的电子为0.1mol×10=1mol;0.1mol硫化氢含有质子数为0.1mol×(1×2+16)×NA=1.8×6.02×1023(或1.8NA),
硫化氢的摩尔质量为34g/mol,同质量的氨气和硫化氢的物质的量之比为
 :
: =2:1,
=2:1,则同质量的氨气和硫化氢气体中分子个数比为2:1,
含氢原子个数比为2×3:1×2=3:1,
由ρ=
 可知标准状况下硫化氢的密度为
可知标准状况下硫化氢的密度为 =1.52g?L-1,
=1.52g?L-1,故答案为:2.24;1;1.08×6.02×1024(或1.8NA);2:1;3:1;1.52g?L-1.
点评:本题考查物质的量的有关计算及阿伏伽德罗定律,熟悉以物质的量为中心的计算公式及物质的构成、阿伏伽德罗定律及其推断等即可解答,题目难度不大.

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案为了防治环境污染并对尾气进行综合利用,某硫酸厂用氨水吸收尾气中的SO2,再向吸收液中加入浓硫酸,以回收高浓度的SO2并得到副产品化肥(NH4)2SO4和NH4HSO4。为测定上述(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液各40.00mL,加热至120℃左右,使氨气全部逸出[已知:(NH4)2SO4和NH4HSO4的分解温度均高于200℃],测得有关实验数据如下(标准状况):
| 实验序号 | 样品的质量/g | NaOH溶液的体积/mL | 氨气的 |
| Ⅰ | 7.4 | 40.00 | 1.68 |
| Ⅱ | 14.8 | 40.00 | 3.36 |
| Ⅲ | 22.2 | 40.00 | 1.12 |
| Ⅳ | 37.0 | 40.00 | 0 |
(1)测定过程中有关反应的离子方程式为
_____________________________ 。
(2)3.7g该样品进行同样实验时,生成的氨气在标准状况下体积为__________L。
(3)试求算该混合物中(NH4)2SO4和NH4HSO4的物质的量之比。
(4)欲计算该NaOH溶液的物质的量浓度应选择第______组数据,并由此计算NaOH溶液的物质的量浓度,写出计算过程。
为了防治环境污染并对尾气进行综合利用,某硫酸厂用氨水吸收尾气中的SO2,再向吸收液中加入浓硫酸,以回收高浓度的SO2并得到副产品化肥(NH4)2SO4和NH4HSO4。为测定上述(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液各40.00mL,加热至120℃左右,使氨气全部逸出[已知:(NH4)2SO4和NH4HSO4的分解温度均高于200℃],测得有关实验数据如下(标准状况):
|
实验序号 |
样品的质量/g |
NaOH溶液的体积/mL |
氨气的体积/L |
|
Ⅰ |
7.4 |
40.00 |
1.68 |
|
Ⅱ |
14.8 |
40.00 |
3.36 |
|
Ⅲ |
22.2 |
40.00 |
1.12 |
|
Ⅳ |
37.0 |
40.00 |
0 |
(1)测定过程中有关反应的离子方程式为
_____________________________ 。
(2)3.7g该样品进行同样实验时,生成的氨气在标准状况下体积为__________L。
(3)试求算该混合物中(NH4)2SO4和NH4HSO4的物质的量之比。
(4)欲计算该NaOH溶液的物质的量浓度应选择第______组数据,并由此计算NaOH溶液的物质的量浓度,写出计算过程。