题目内容
下列7项判断中合理的有几项( )
①根据分散剂直径的大小,把分散系分为浊液、胶体、溶液
②根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
③合金的熔点通常比组分金属高,硬度比组分金属大
④根据元素原子最外层电子数的多少将元素分为金属和非金属
⑤根据反应的热效应将化学反应分为放热反应和吸热反应
⑥根据电解质在熔融状态下能否完全电离将电解质分为强电解质和弱电解质
⑦酸性氧化物都是非金属氧化物.
①根据分散剂直径的大小,把分散系分为浊液、胶体、溶液
②根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
③合金的熔点通常比组分金属高,硬度比组分金属大
④根据元素原子最外层电子数的多少将元素分为金属和非金属
⑤根据反应的热效应将化学反应分为放热反应和吸热反应
⑥根据电解质在熔融状态下能否完全电离将电解质分为强电解质和弱电解质
⑦酸性氧化物都是非金属氧化物.
| A、1项 | B、2项 | C、3项 | D、4项 |
考点:分散系、胶体与溶液的概念及关系,氧化还原反应,吸热反应和放热反应,强电解质和弱电解质的概念
专题:
分析:①当分散剂是水或其他液体时,根据分散质粒子大小分类;
②氧化还原反应中存在电子转移;
③根据合金的性质分析;
④非金属元素原子的最外层电子数可能比金属少,也可能多;
⑤化学反应中一定存在能量变化;
⑥在溶液中完全电离的电解质属于强电解质;
⑦金属氧化物也可能是酸性氧化物.
②氧化还原反应中存在电子转移;
③根据合金的性质分析;
④非金属元素原子的最外层电子数可能比金属少,也可能多;
⑤化学反应中一定存在能量变化;
⑥在溶液中完全电离的电解质属于强电解质;
⑦金属氧化物也可能是酸性氧化物.
解答:
解:①当分散剂是水或其他液体时,根据分散质粒子大小,可以把分散系分为溶液、胶体、浊液,故正确;
②氧化还原反应的本质是电子转移,则根据反应是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应,故正确;
③合金的熔点通常比组分金属低,硬度比组分金属大,故错误;
④与金属元素同主族的非金属元素有很多,它们与同主族金属元素具有相同的最外层电子数,例如氢原子最外层只有一个电子和金属钠一样,但它不是金属,再如硫和钋最外层电子都是6,但前者是非金属,后者是金属,所以不能根据元素原子最外层电子数的多少将元素分为金属和非金属元素,故错误;
⑤化学反应中一定存在能量变化,所以根据反应的热效应将化学反应分为放热反应和吸热反应,故正确;
⑥在溶液中完全电离的电解质属于强电解质,则根据电解质在水溶液中能否完全电离将电解质分为强电解质和弱电解质,故错误;
⑦金属氧化物也可能是酸性氧化物,如Mn2O7是金属氧化物,属于酸性氧化物,故错误.
故选C.
②氧化还原反应的本质是电子转移,则根据反应是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应,故正确;
③合金的熔点通常比组分金属低,硬度比组分金属大,故错误;
④与金属元素同主族的非金属元素有很多,它们与同主族金属元素具有相同的最外层电子数,例如氢原子最外层只有一个电子和金属钠一样,但它不是金属,再如硫和钋最外层电子都是6,但前者是非金属,后者是金属,所以不能根据元素原子最外层电子数的多少将元素分为金属和非金属元素,故错误;
⑤化学反应中一定存在能量变化,所以根据反应的热效应将化学反应分为放热反应和吸热反应,故正确;
⑥在溶液中完全电离的电解质属于强电解质,则根据电解质在水溶液中能否完全电离将电解质分为强电解质和弱电解质,故错误;
⑦金属氧化物也可能是酸性氧化物,如Mn2O7是金属氧化物,属于酸性氧化物,故错误.
故选C.
点评:本题考查物质分类以及有关概念的辨析,题目难度不大,注意物质的分类的依据.

练习册系列答案
相关题目
氟里昂(CCl2F2:二氟二氯甲烷)是常用的制冷剂,但近年的研究表明,它会破坏臭气层.现科学家研究出它的一种替代品:CH2F2(二氟甲烷),关于二氟甲烷的叙述不正确的是( )
| A、它可能是甲烷与氟气发生取代的产物 |
| B、它有两种同分异构体 |
| C、它属于烃的衍生物 |
| D、它不存在同分异构现象 |
将①H+②Cl-③Al3+④K+⑤O2-五种微粒分别加入水中,基本上不影响水的电离平衡的有 ( )
| A、①②④⑤ | B、②④⑤ |
| C、①③⑤ | D、②④ |
下列溶液中,Na+的物质的量浓度最大的是( )
| A、1 mL 0.5 mol?L-1的NaOH溶液 |
| B、100 mL 0.01 mol?L-1的NaCl溶液 |
| C、100 mL 0.1 mol-1的NaOH溶液 |
| D、10 mL 0.1 mol?L-1的Na2SO4溶液 |
可以把 转变成
转变成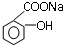 的方法是( )
的方法是( )
 转变成
转变成 的方法是( )
的方法是( )| A、加入足量的NaOH(aq)并加热 |
| B、与足量NaOH(aq)共热后,通入足量CO2 |
| C、与盐酸共热后,加入足量的NaOH(aq) |
| D、与稀硫酸共热后,加入足量Na2CO3 (aq) |
