题目内容
工业上制取铝的流程如下:

注:冰晶石的作用是使E在较低温度下熔化。
(1)试写出下列物质的化学式:
A____________,B____________,C____________,?D____________?,E____________。
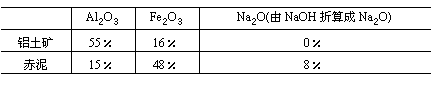
(2)在用此法制取铝时,分析铝土矿和赤泥(提取Al2O3之后的残渣)所得数据如下:
| Al2O3 | Fe2O3 | Na2O | 铝土矿 |
| 55% | 16% | 0% | 赤泥 |
| 15% | 48% | 8% |
试求制取1 t Al2O3所需铝矾土和苛性钠的质量。
(1)NaOH NaAlO2 Na2CO3 Al(OH)3?Al2O3
(2)2 t 0.068 t?
解析:
从流程图分析可知A为NaOH,它使Al2O3变为NaAlO2,然后通入CO2又转变为Al(OH)3。Fe2O3不与NaOH反应,NaOH可将Fe2O3从铝土中全部转移到赤泥中去。从Fe2O3在铝土矿中的含量及在赤泥中的含量可知,赤泥的质量为铝土矿质量的![]() 。设需铝土矿x t,则:?
。设需铝土矿x t,则:?
x×55%-![]() ×x×15%=1
×x×15%=1
解得:x=2,即需铝土矿2 t。?
因NaOH可循环使用,因此需要补充NaOH的量即为留在赤泥中的NaOH的量(全部转化为Na2O):?
m(NaOH)=![]() ×2 t×8%×
×2 t×8%×![]() =0.068 t
=0.068 t

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
工业上从铝土矿(含氧化铝、氧化铁等)制取铝的流程如图所示:

经分析,生产原料(铝土矿)和提取Al2O3后的残渣(赤泥)的部分成分见下表(以氧化物表示)。已知铝土矿中的Fe2O3全部转入赤泥。
|
|
Al2O3 |
Fe2O3 |
Na2O(由NaOH折算成Na2O) |
|
铝土矿 |
55% |
16% |
0% |
|
赤泥 |
15% |
48% |
8% |
(1)生产中每消耗1 t铝土矿将产生多少t赤泥?
(2)试计算出每炼1 t铝,理论上需要多少t铝土矿?应补充多少t NaOH?