题目内容
18.铜单质及其化合物在很多领域有重要用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂.(1)Cu位于元素周期表第四周期第ⅠB 族.Cu2+的核外电子排布式为[Ar]3d9或1s22s22p63s23p63d9.
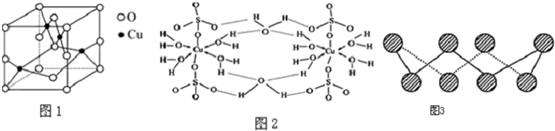
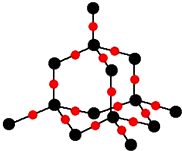
(2)如图1是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为4.
(3)胆矾CuSO4•5H2O可写成[Cu(H2O)4]SO4•H2O,其结构示意图如图2:下列说法正确的是BD (填字母).
A.在上述结构示意图中,所有氧原子都采用sp3杂化
B.在上述结构示意图中,存在配位键、共价键和离子键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子.已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是:F的电负性比N大,N-F成键电子对偏向F,导致NF3中氮原子核对其孤电子对的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子
(5)Cu2O的熔点比Cu2S的高(填“高”或“低”),请解释原因:Cu2O与Cu2S相比,阳离子相同、阴离子所带的电荷数也相同,但O2-半径比S2-半径小,所以Cu2O的晶格能更大,熔点更高.
(6)S单质的常见形式为S8,其环状结构如图3所示,S原子采用的轨道杂化方式是sp3 _
(7)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为O>S>Se;
分析 (1)根据Cu的电子排布式书写Cu2+离子的电子排布式;
(2)利用均摊法分析晶胞的结构;
(3)根据结构示意图中所有氧原子都是饱和氧原子,存在O→Cu配位键,H-O、S-O共价键和Cu、O离子键,胆矾属于离子晶体以及胆矾晶体中水两类,一类是形成配体的水分子,一类是形成氢键的水分子等角度分析;
(4)根据电负性的角度分析;
(5)从影响离子晶体熔沸点高低的角度分析;
(6)根据图片知,每个S原子含有2个σ键和2个孤电子对,根据价层电子对互斥理论确定S原子杂化方式;
(7)根据同一主族元素的第一电离能递变规律判断.
解答 解:(1)Cu(电子排布式为:[Ar]3d104s1)Cu2+的过程中,参与反应的电子是最外层的4s及3d上各一个电子,故Cu2+离子的电子排布式是为:[Ar]3d9或1s22s22p63s23p63d9,
故答案为:[Ar]3d9或1s22s22p63s23p63d9;
(2)从图中可以看出阴离子在晶胞有四类:顶点(8个)、棱上(4个)、面上(2个)、体心(1个),根据立方体的分摊法,可知该晶胞中阴离子数目为:8×$\frac{1}{8}$+4×$\frac{1}{4}$+2×$\frac{1}{2}$+1=4,
故答案为:4;
(3)A.氧原子并不都是sp3杂化,该结构中的氧原子部分饱和,部分不饱和,杂化方式不同.从现代物质结构理论出发,硫酸根离子中S和非羟基O之间除了形成1个σ键之外,还形成了反馈π键.形成π键的电子不能处于杂化轨道上,O必须保留未经杂化的p轨道,就不可能是sp3杂化,故A错误;
B.在上述结构示意图中,存在O→Cu配位键,H-O、S-O共价键和Cu、O离子键,故B正确;
C.胆矾是五水硫酸铜,胆矾是由水合铜离子及硫酸根离子构成的,属于离子晶体,故C错误;
D.由于胆矾晶体中水两类,一类是形成配体的水分子,一类是形成氢键的水分子,结合上有着不同,因此受热时也会因温度不同而得到不同的产物,故D正确;
故答案为:BD;
(4)N、F、H三种元素的电负性:F>N>H,所以NH3中共用电子对偏向N,而在NF3中,共用电子对偏向F,偏离N原子,所以NF3不易与Cu2+形成配离子,
故答案为:F的电负性比N大,N-F成键电子对偏向F,导致NF3中氮原子核对其孤电子对的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子;
(5)由于氧离子的离子半径小于硫离子的离子半径,所以亚铜离子与氧离子形成的离子键强于亚铜离子与硫离子形成的离子键,所以Cu2O的熔点比Cu2S的高.
故答案为:高;Cu2O与Cu2S相比,阳离子相同、阴离子所带的电荷数也相同,但O2-半径比S2-半径小,所以Cu2O的晶格能更大,熔点更高;
(6)根据图片知,每个S原子含有2个σ键和2个孤电子对,所以每个S原子的价层电子对个数是4,则S原子为sp3杂化,
故答案为:sp3;
(7)同主族元素从上到下,原子半径越来越大,原子核对核外电子的吸引力越来越弱,第一电离能逐渐减小,
故答案为:O>S>Se.
点评 本题考查位置、结构与性质关系的综合应用,题目难度中等,涉及常见元素核外电子排布、电负性概念、常见轨道杂化类型、以及离子晶体的晶胞结构、化学键、物质性质、配合物成键状况等知识,学习中注意加强对晶胞以及晶体结构的分析.

| A. | 用白醋除铁锈:Fe2O3•xH2O+6H+═(3+x)H2O+2Fe3+ | |
| B. | 向Ba(OH)2溶液中加入少量的NH4HSO4溶液:Ba2++2OH-+N${{H}_{4}}^{+}$+H++S${{O}_{4}}^{2-}$═BaSO4↓+NH3•H2O+H2O | |
| C. | 纯碱溶液和苯酚反应:C${{O}_{3}}^{2-}$+2C6H5OH→2C6H5O-+CO2↑+H2O | |
| D. | 用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2═I2+2OH- |
| A. | 蛋白质在空气中完全燃烧转化为水和二氧化碳 | |
| B. | 汽油、甘油、花生油都属于酯类物质 | |
| C. | 麦芽糖及其水解产物均能发生银镜反应 | |
| D. | 燃煤产生的二氧化硫是引起雾霾的主要原因 |
| A. | D元素处于元素周期表中第3周期第Ⅳ族 | |
| B. | 四种元素的原子半径:r(A)<r(B)<r(C)<r(D) | |
| C. | B、D的最高价氧化物中,B、D与氧原子均为双键 | |
| D. | 一定条件下,B单质能转换出D单质,C产单质能置换出A单质 |
| A. | 向氯化铝溶液中滴加过量氨水,生成白色胶状沉淀:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | 加入足量的氢氧化镁以除去氯化镁溶液中的少量氯化铁:Fe3++3OH-═Fe(OH)3↓ | |
| C. | 常温下0.1mol/L 氯化铵溶液pH=5:NH4++H2O?NH3•H2O+H+ | |
| D. | 电解精炼铜时阳极铜溶解:Cu-2e-═Cu2+ |
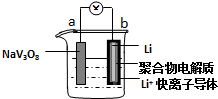
| A. | 放电时,该电池的总反应为:xLi+NaV3O8═NaLixV3O8 | |
| B. | 充电过程中Li+从阳极向阴极迁移 | |
| C. | 充电过程中阳极的电极反应式为NaLixV3O8-xe-═NaV3O8+xLi+,NaLixV3O8中钒的化合价发生变化 | |
| D. | 该电池可以用硫酸钠溶液作电解质 |
 ;
;
 现代世界产量最高的金属是Fe、Al、Cu.
现代世界产量最高的金属是Fe、Al、Cu. )分子中碳原子杂化类型为SP2,分子中σ键比π键多5个.
)分子中碳原子杂化类型为SP2,分子中σ键比π键多5个.